Also available : English version
Informations
Pour visualiser les molécules en 3D, votre navigateur doit être équipé du
plug-in CHIME. Des
formules de molécules sont proposées dans les exercices sous forme de liens
hypertextes. Ces liens renvoient à une
banque de données moléculaire où l'on
pourra trouver d'autres exemples et les caractéristiques géométriques des
molécules présentées sous forme de tableau.
Ce texte existe également en
version anglaise.
Introduction La constitution d'une molécule est l'ensemble de ses atomes enchaînés les uns
aux autres par des liaisons. On la schématise par la formule de Lewis dans
laquelle les liaisons sont représentées par des tirets joignant les atomes et
les doublets non liant par deux points (ou un tiret) sur le symbole de l'atome
considéré. La stéréochimie absolue d'une molécule est l'arrangement de ses atomes dans
l'espace. De nombreuses propriétés physiques et chimiques sont la conséquence
d'une stéréochimie particulière. Dans ce chapitre, on se propose d'étudier la
stéréochimie des molécules et des ions polyatomiques. Nous traiterons le cas
simple dans lequel on peut distinguer sans ambiguïté un atome central (noté A)
et des atomes périphériques (notés X). Nous ferons l'hypothèse que l'atome
central n'appartient pas à la famille des éléments de transition. Résultats expérimentaux Le dioxyde de soufre est très soluble dans l'eau. Le dioxyde de carbone l'est
beaucoup moins. Cette différence de comportement à l'échelle macroscopique
s'interprète à l'échelle microscopique par des stéréochimies différentes des
molécules. Les molécules CO2 et SO2 possèdent chacune deux
atomes d'oxygène lié à un atome central. Le spectre infrarouge de CO2
est en faveur d'une molécule linéaire tandis que celui de SO2 montre
qu'elle a une forme coudée. Ainsi, le moment dipolaire de SO2 n'est
pas nul ce qui lui permet d'interagir avec l'eau tandis que celui de
CO2 est nul par compensation des moments dipolaires de liaisons.
De nombreuses méthodes physico-chimiques concourent pour déterminer la stéréochimie moléculaire : spectrographie des rayons X, diffraction électronique et neutronique, spectroscopies (UV, I.R, Raman, micro-ondes etc). La RMN et la RPE (pour les radicaux) permettent également d'obtenir des informations précieuses notamment dans le domaine de la dynamique moléculaire.
A l'heure actuelle on connait de façon très précise les distances interatomiques et les angles entre les liaisons de dizaines de milliers de molécules. Un des aspects importants de la stéréochimie consiste à expliquer et si possible à prévoir la stéréochimie d'une molécule donnée.
Principes de la méthode VSEPR
Origine
Les électrons de la couche de valence de la plupart des molécules et des ions stables sont en nombre pair (il existe des molécules possèdant un nombre impair d'électrons comme NO2 mais cela reste assez rare). Le principe de Pauli (1920) nous indique que seuls les électrons possèdant des nombres quantiques de spin opposés évoluent dans une même région de l'espace car ils sont décrits par la même orbitale. Ces électrons peuvent être groupés par paires ou doublets.
Dans le modèle de Lewis, la liaison entre deux atomes est décrite par la mise en commun d'un doublet d'électrons : on l'appelle doublet liant. Les paires d'électrons non employées pour décrire les liaisons constituent les doublets non liants notés E.
|
Doublets |
Liants |
Non liants |
|
Nombre |
n |
m |
Principes de base
L'approximation de départ de la théorie consiste à assimiler les paires
d'électrons à des charges électriques ponctuelles. Celles de la couche de
valence évoluent à une distance comparable du noyau de l'atome. En première
approximation, elles sont assujetties à se déplacer sur une sphère dont le
centre est occupé par le noyau. L'arrangement géométrique qu'elles adoptent sur
cette sphère est la conséquence de leur répulsion mutuelle.
Bien qu'il ne s'agisse pas à proprement parler d'une interaction électrostatique entre charges ponctuelles, car le comportement des électrons est régi par les lois de la mécanique quantique, on obtient un résultat correct en recherchant l'arrangement qui rend maximum les distances entre les paires d'électrons.
A ce premier niveau d'approximation, il n'y a pas de distinction à faire entre un doublet liant et un doublet non liant.
Dans ces conditions, l'arrangement qui minimise la répulsion des doublets dépend seulement de leur nombre : m + n. Cela correspond aux figures géométriques suivantes en se limitant à la coordination six.
|
m + n |
Figure géométrique |
|
2 |
Segment de droite |
|
3 |
Triangle |
|
4 |
Tétraèdre |
|
5 |
Bipyramide trigonale |
|
6 |
Octaèdre |
A ces cinq types de figures géométriques, correspondent davantage d'arrangements des paires d'électrons que nous allons passer en revue. Dans ce qui suit X désigne un atome et E un doublet non liant.
En première approximation, les liaisons multiples sont traitées comme si elles ne faisaient intervenir qu'un seul doublet.
Nous prendrons des exemples de molécules avec des liaisons simples et des molécules avec des liaisons multiples.
Les différents arrangements des doublets
Arrangement linéaire
![]()
Le béryllium, élément de la seconde colonne de la classification périodique de configuration électronique [He] : 2s2, est lié par 2 liaisons simples à deux atomes de chlore dans la molécule BeCl2.
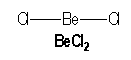
|
AX2 |
Molécules avec des liaisons multiples :
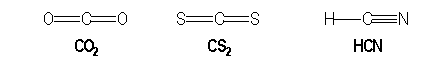
|
AX2 |
AX2 |
AX2 |
Exercice : dessiner les formules de Lewis des molécules suivantes puis vérifier leur appartenance à la famille indiquée et leur stéréochimie.
|
AX2 |
Arrangement triangulaire
On distingue deux familles :

Molécules avec des liaisons simples :
|
B |
Sn |
|
[He] 2s2 2p1 |
[Kr] 4d10 5s2 5p2 |
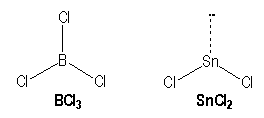
|
AX3 |
AX2E |
Molécules avec des liaisons multiples :
|
S |
O |
N |
|
[Ne] 3s2 3p4 |
[He] 2s2 2p4 |
[He] 2s2 2p3 |
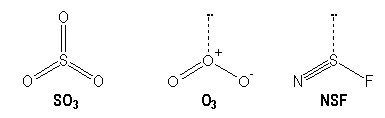
|
AX3 |
AX2E |
AX2E |
Exercice : dessiner les formules de Lewis des molécules et des ions suivants puis vérifier leur appartenance à la famille indiquée et leur stéréochimie.
|
AX3 |
AX2E |
Arrangement tétraédrique
On distingue trois familles :
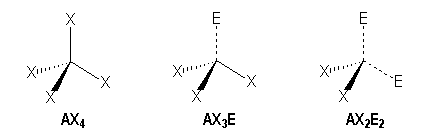
Molécules avec des liaisons simples :
|
Si |
P |
O |
|
[Ne] 3s2 3p2 |
[Ne] 3s2 3p3 |
[He] 2s2 2p4 |

|
AX4 |
AX3E |
AX2E2 |
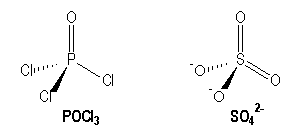
Molécules avec des liaisons multiples :
|
P |
S |
|
[Ne] 3s2 3p1 |
[Ne] 3s2 3p4 |
|
AX4 |
AX4 |
Exercice : dessiner les formules de Lewis des molécules et des ions suivants. Vérifier les familles auxquelles ils appartiennent et leur stéréochimie.
|
AX4 |
AX3E |
AX2E2 |
Arrangement pentagonal
La figure géométrique la plus répandue et qui est la plus stable correspondant à cet arrangement est la bipyramide trigonale. Une complication apparaît ici du fait de la non équivalence des positions aux sommets de la bipyramide. On peut les classer en deux catégories : axiales (a) et équatoriales (e) :

Le problème peut être résolu en affinant les hypothèses de la méthode. A un deuxième niveau d'approximation les paires liantes et non- liantes sont traitées différemment : la position dans l'espace des électrons constituant un doublet liant est contrôlée par le champ exercé par les noyaux de deux atomes, celle des électrons d'un doublet non liant par un seul noyau, celui de l'atome central. Il est donc raisonnable d'admettre que le volume moyen dans lequel évolue les électrons d'un doublet non liant, est supérieur à celui dont disposent les électrons d'un doublet liant. Ces considérations simples permettent d'établir la hiérarchie suivante dans la répulsion entre les paires :
NL-NL (x) > NL-L (y) > L-L (z)
Un paramètre pratique pour évaluer l'ordre de grandeur de la répulsion entre les doublets, est l'angle au centre a formé par les directions entre ceux-ci et l'atome central. En utilisant ce paramètre, on peut comparer les énergies des deux arrangements (1) et (2) en décomptant les interactions sur la base des inégalités précédentes.
Tenons- compte seulement des interactions pour lesquelles a £ 90° les autres étant supposées négligeables.
|
Arrangement (1) |
Arrangement (2) |
|
le doublet E interagit avec 2 atomes X |
le doublet E interagit avec 3 atomes X |
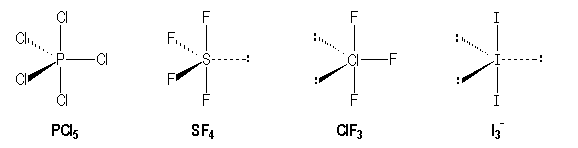
Le premier arrangement est donc plus stable que le second. A cet arrangement correspond une catégorie de molécules qu'on peut appeler avec Gillespie molécules disphénoïdes et à laquelle appartient SF4. Expérimentalement, on ne connait pas de stéréoisomère de cette molécule.
Une étude du même type effectuée pour les autres arrangements a priori possibles en géométrie pentagonale, montre que les paires électroniques non liantes doivent occuper de façon préférentielle les positions équatoriales.
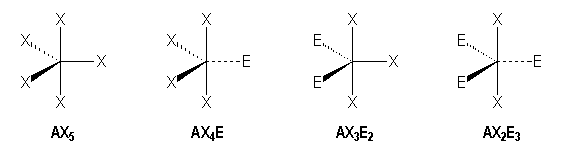
Molécules avec des liaisons simples :
|
P |
S |
Cl |
I |
|
[Ne] 3s2 3p3 |
[Ne] 3s2 3p4 |
[Ne] 3s2 3p5 |
[Kr] 4 d10 5s2 5p5 |
|
AX5 |
AX4E |
AX3E |
AX2E3 |
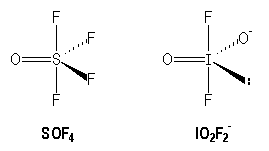
Molécules et ions avec des liaisons multiples :
|
S |
I |
|
[Ne] 3s2 3p4 |
[Kr] 4 d10 5s2 5p5 |
|
AX5 |
AX4E | |
Exercice : dessiner les formules de Lewis des molécules et des ions suivants. Vérifier les familles auxquelles ils appartiennent et leur stéréochimie.
|
AX5 |
AX4E |
Arrangement octaédrique
On distingue les familles suivantes :

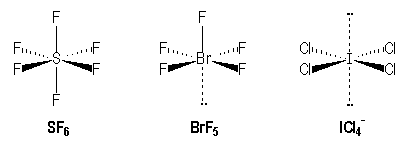
Molécules avec des liaisons simples :
|
S |
Br |
I |
|
[Ne] 3s2 3p4 |
[Kr] 3 d10 4s2 4p5 |
[Kr] 4 d10 5s2 5p5 |
|
AX6 |
AX5E |
AX4E2 |
Molécules avec des liaisons multiples :
|
I |
Xe |
|
[Kr] 4 d10 5s2 5p5 |
[Kr] 4 d10 5s2 5p6 |

|
AX6 |
AX5E |
Effets du second ordre
Influence de la nature des doublets sur les angles entre les liaisons
|
109,5° |
107° |
104,5° |
On observe une évolution du même type pour les dérivés ioniques de l'ammoniac :
|
NH4+ |
NH3 |
NH2- |
|
109,5° |
107° |
104° |
Influence du volume des liaisons multiples
Comme on l'a vu, la forme géométrique globale ne dépend que des liaisons
s. On peut donc classer les molécules possèdant des
liaisons multiples dans les mêmes groupes que celles qui possèdent des liaisons
simples. En revanche le volume occupé par les électrons dans l'espace croit avec
l'ordre de liaison. On assiste donc à une fermeture de l'angle opposé à la
liaison multiple.
Arrangement triangulaire
Dans les molécules de HCHO et de COCl2 représentées ci-dessous, l'angle entre les liaisons simples est inférieur à 120°.
|
115,8° |
111,3° |
Arrangement tétraédrique
On assiste à la fermeture de l'angle entre les liaisons simples au fur et à mesure que l'ordre de liaisons croit dans la série : SiF4, POF3, NSF3.
|
109,5° |
102° |
98° |
Arrangement pentagonal
L'angle FOF est inférieur à 120° dans SOF4.
|
110° |
Influence de la différence d'électronégativité entre les atomes
Le volume occupé par les doublets liants décroît lorsque la différence
d'électronégativité des atomes liés augmente. Drainés vers l'atome le plus
électronégatif, les électrons de liaison davantage confinés dans l'espace
internucléaire se repoussent moins. Pour un même atome central on observe une
diminution de l'angle entre les liaisons avec l'accroissement de
l'électronégativité de l'atome périphérique. L'évolution des angles dans la
série : PI3, PBr3, PCl3, PF3 en
témoigne.
|
102° |
101,5° |
100,3° |
97,8° |
Les molécules NH3, PH3, AsH3 ont chacune trois atomes d'hydrogène et des atomes centraux de moins en moins électronégatifs.
|
Elément |
N |
P |
As |
|
c (Pauling) |
3,04 |
2,19 |
2,17 |
En passant de NH3 à PH3 puis AsH3, la mise en commun des électrons de liaison est de plus en plus importante et les doublets de liaisons occupent de moins en moins de place dans l'espace. On observe une diminution de l'angle au sommet de la pyramide.
|
107° |
93,83° |
91,58° |
|
118° |
109° |
|
liaison |
P-Cléq |
P-Clax |
|
d (nm) |
0,202 |
0,214 |
La non équivalence entre position axiale et équatoriale se manifeste également pour les doublets liants. Dans la molécule PF3Cl2, Cl est moins électronégatif que F. Le doublet assurant la liaison entre P et Cl occupe une place plus grande que celui entre P et F. On explique ainsi que l'isomère dans lequel ces atomes sont en position équatoriale soit le plus stable.
|
PCl5 |
PF3Cl2 |
Pour les molécules de type AX5E comme BrF5, on observe une légère diminution de l'angle entre les liaisons (85° au lieu de 90°) et une liaison axiale plus longue que la liaison équatoriale.
|
liaison |
Br-Féq |
Br-Fax |
|
d (nm) |
0,177 |
0,168 |
Limites de la méthode VSEPR
La méthode VSEPR permet la plupart du temps la prédiction correcte de l'arrangement local des paires d'électrons autour d'un atome lorsque celui-ci peut être choisi sans ambiguïté comme atome central. En revanche, son application est beaucoup plus problématique quand il s'agit de prévoir la géométrie globale de molécules complexes. Ainsi il n'est pas possible de prévoir la planéité de la molécule d'éthylène ni d'expliquer pourquoi chez les allènes les substituants sont situés dans des plans perpendiculaires.
Par ailleurs les molécules ne sont pas des objets statiques. Cela est particulièrement net dans des molécules faisant intervenir des atomes pyramidaux comme NH3, PH3 . Il existe aussi des phénomènes plus complexes comme l'échange des positions axiale et équatoriale en géométrie pentagonale (pseudo- rotation de Berry).
References
R. J Gillespie et R. S Nyholm - Quart. Rev., 1957, 11, 339.
R. J Gillespie - Actualité chimique, 1973, 4, 27.
R. J Gillespie - Molecular geometry, 1972. Van Nostrand Reihold, Londres.
G. Fontaine - Bulletin de l'union des physiciens n° 591 p. 559-568.
J. Sala- Pala - Bulletin de l'union des physiciens n° 648 p. 201-244.
N. N Greenwood and A. Earnshaw - Chemistry of the elements Pergamon Press
1984.
VSEPR Theorie - Caroline Röhr, Universität Freiburg
VSEPR - by M. Lerner, Oregon State University
VSEPR - by Mark Winter, University of Sheffield
VSEPR - by John J. Nash, Purdue University
[RETOUR AU MENU DU COURS] - [BANQUE DE MOLECULES]
Gérard Dupuis - Lycée Faidherbe - LILLE
septembre 2000