Chapitre 17. Systèmes électrochimiques en
fonctionnement.
André FONTANA, C.Gisèle JUNG
Université Libre de Bruxelles
A)
Introduction.
Lorsqu’une électrode
est parcourue par un courant électrique, celle-ci sort de l’équilibre soit dans
le sens de la réduction (elle joue le rôle de cathode), soit dans le sens de
l’oxydation (elle joue le rôle d’anode).
Les potentiels
d’électrode ne correspondent plus aux potentiels d’équilibre (E), mais aux
potentiels dits galvaniques (U). Il faudra de plus tenir compte de la chute
ohmique RI dans l’électrolyte.
B)
Tension aux bornes hors équilibre
– potentiels galvaniques
Pour sortir de
l’équilibre dans le sens de la réduction, il faut injecter des électrons en
abaissant le potentiel d’une tension hC (<0) appelée
surtension cathodique1. Le potentiel galvanique UC de la
cathode s’établit dès lors à : UC = EC - |hC|
Pour sortir de
l’équilibre dans le sens de l’oxydation, il faut retirer des électrons en
élevant le potentiel d’une tension hA appelée surtension
anodique[1].
Le potentiel galvanique UA de l’anode s’établit dès lors
à : UA
= EA + hA
On peut alors définir la différence de potentiel aux bornes UCA du système électrochimique de la manière suivante en tenant compte de la chute ohmique RI dans la solution :
UCA + RI
= (EC - |hC|) - (EA + hA),
Ou encore :
UCA = EC – EA - |hC| - hA – RI > 0
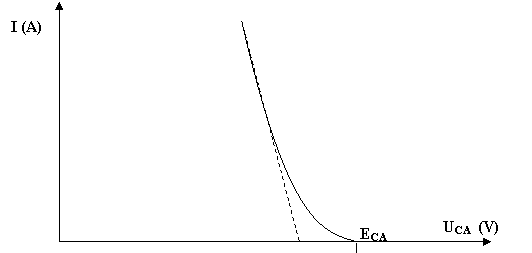
1) Cas d’une pile (ECA
> 0)
On en déduit que pour une pile, la différence de potentiel en fonctionnement sera toujours inférieure à la différence de potentiel au repos (à l’équilibre).
2) Cas d’un électrolyseur
Partons de la
relation UCA = EC – EA -
|hC| - hA – RI < 0
Rappelons que EC
– EA est négatif, de même que UCA. Multiplions les
deux membres de cette expression par (-1) et remplaçons UCA par –UAC :
UAC = EA – EC + hA + |hC| +RI > 0
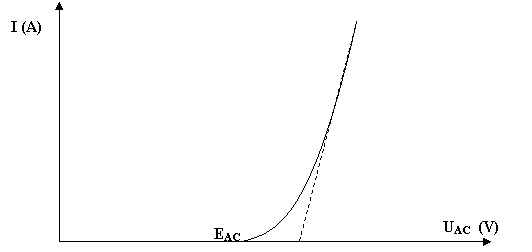 On en déduit que pour un électrolyseur, la différence de potentiel en
fonctionnement sera toujours supérieure à la différence de potentiel au
repos (à l’équilibre).
On en déduit que pour un électrolyseur, la différence de potentiel en
fonctionnement sera toujours supérieure à la différence de potentiel au
repos (à l’équilibre).
C)
LOIS DE FARADAY
Les lois de Faraday résultent d’une série d’expériences quantitatives qui datent de 1833 et qui relient la quantité de matière mise en œuvre à une électrode à l’intensité de courant qui la traverse.
Si on s’intéresse à la réaction Ox + n.e- ® Red, on remarque qu’il faut n moles d’électrons pour consommer une mole de l’espèce Ox ou pour produire une mole de l’espèce Red.
Or, une mole d’électrons porte une charge correspondant à la charge de l’électron (1,602.10-19C) multipliée par le nombre d’électrons par mole (NAV = 6,02.1023 électrons/mole).
On en déduit la constante de Faraday : F = 1,602.10-19´6,02.1023 = 96487 C/mol (A.s/mol)
Il faudra donc faire passer n moles d’électrons (soit n.F Coulombs) pour produire une mole de Red (ou consommer une mole d’Ox).
Si l’électrode est parcourue par un courant d’intensité I ampères pendant un temps t (s), la charge qui a traversé l’électrode est de I´t Coulombs (ou A.s). La quantité de matière (en moles) mise en jeu à l’électrode correspondra donc à :
![]()
Pour connaître la masse de matière impliquée par la réaction électrochimique, connaissant sa masse molaire MM, on a :
![]() (g) avec
e = MM/n (masse équivalente)
(g) avec
e = MM/n (masse équivalente)
Si on exprime le temps Q en heures, la constante de Faraday vaut 26,8 A.h/mol :
![]() (g)
(g)
Exemples
Calcul de masses équivalentes
• Ag+ + e ® Ag e = 107,1/1 = 107,1 g/mol
• Cu2+ + 2e ® Cu e = 63,5/2 = 31,75 g/mol
• Cu+ + e ® Cu e = 63,5/1 = 63,5 g/mol
• Al3+ + 3e ® Al e = 27/3 = 9 g/mol
Calcul de la quantité de matière
produite à une électrode
•
Electrolyse du cuivre à 10A
pendant 24h (Cu2+ + 2e ® Cu) :
masse de cuivre produite : p
= (10´24´63,5)/(2´26,8) = 284g
•
Electrolyse de NaCl à 100A
pendant 48h (2Cl- ® Cl2
+ 2e)
masse de chlore produit : p
= (100´48´71)/(2´26,8) = 6358g
Une mole de chlore pesant 71g et occupant 22,4dm3 dans les
conditions Normales,
le volume de chlore dégagé vaudra : V
= 6358´22,4/71 = 2006 dm3
Rendement
da courant (rendement faradique)
Pour un électrolyseur :
Lorsque plusieurs réactions se déroulent simultanément à une électrode, seule une part rc du courant d’électrons est utilisée pour la réaction concernée. On peut dès lors calculer la quantité réelle de matière mise en œuvre à l’électrode :
![]() (g)
(g)
Pour une pile :
Une fraction rc de la matière mise en jeu à l’électrode participe réellement à la réaction électrochimique, de sorte que on peut écrire :
![]() (g)
(g)
D)
Production spécifique d’énergie d’une pile
On peut calculer l’énergie produite par une pile en fonction des quantités de matière réactives consommées aux électrodes. L’énergie W (J = W.s) fournie par la pile est égale au produit de l’intensité du courant I (A) par la tension aux bornes UCA (V) et par le temps t (s) :
W = UCA´I´t W.s
Pendant ce temps, la pile a consommé une quantité de matière p (g) donnée par la loi de Faraday :
![]()
On en déduit la quantité d’énergie w (W.s/g) produite par gramme de substance consommée :
![]() (W.s/g)
(W.s/g)
![]() (W.h/g)
(W.h/g)
E)
Consommation spécifique d’énergie d’un electrolyseur
On peut calculer l’énergie consommée par un électrolyseur en fonction des quantités de matière réactives produites aux électrodes. L’énergie W (J = W.s) consommée par l’électrolyseur est égale au produit de l’intensité du courant I (A) par la tension aux bornes UCA (V) et par le temps t (s) :
W = UCA´I´t W.s
Pendant ce temps, l’électrolyseur a produit une quantité de matière p (g) donnée par la loi de Faraday :
![]()
On en déduit la quantité d’énergie w (W.s/g) consommée par gramme de substance produite :
![]() (W.s/g)
(W.s/g)
![]() (W.h/g)
(W.h/g)
Exemples
1. Calculer la consommation spécifique d’énergie pour la production d’hydrogène et d’oxygène par électrolyse de l’eau (en kWh/kg et en kWh/m3). La tension aux bornes est supposée de 2V et les rendements de courant de 94% pour les deux gaz.
• Oxygène : 2H2O
® O2 + 4H+ + 4e e
= 32/4 = 8 g/mol
donc w = 2´26,8/0,94´8 = 7,15 Wh/g (=kWh/kg)
Une mole d’oxygène pesant 32g et occupant 22,4dm3 dans les
conditions Normales, la quantité d’énergie consommée par dm3
d’oxygène sera : 7,15´32/22,4 = 10,2 Wh/ dm3
(kWh/m3)
• Hydrogène : 2H+
+ 2e ® H2 e = 1
g/mol donc w = 2´26,8/0,94´1 = 57,2 Wh/g (=kWh/kg)
Une mole d’hydrogène pesant 2g et occupant 22,4dm3 dans les
conditions Normales, la quantité d’énergie consommée par dm3
d’oxygène sera : 52,7´2/22,4 = 5,1 Wh/ dm3
(kWh/m3)
2. Calculer la consommation spécifique pour la production d’aluminium par électrolyse en sels fondus (UAC = 4,5V, rc = 90%)
• Al3+ + 3e ® Al e = 27/3 = 9 g/mol
donc w = 4,5´26,8/0,9´9 = 14,9 Wh/g (=kWh/kg),
soit 14900 kWh/t
F)
exemples de cellules électrolytiques
Un système est défini par :
· Le matériau des électrodes
· Toutes les espèces qui constituent la solution d’électrolyte (solvant et électrolyte).
Rappelons que pour les systèmes électrochimiques qui convertissent l’énergie chimique en énergie électrique, la réaction chimique globale est spontanée, ce qui correspond à une variation d’enthalpie libre négative, c.-à-d. un potentiel cathodique supérieur au potentiel anodique.
Par contre, pour ce qui est des électrolyseurs, l’enthalpie libre de la réaction globale est positive, la réaction chimique n’est donc en principe pas possible, et on apporte l’énergie nécessaire au système en injectant un courant d’électrons à l’aide d’un générateur de courant continu sous la forme d’une différence de potentiel UAC qui est supérieure au EAC déduit de la relation :
DG = -n. DECA.F = +n. DEAC.F
1) Piles et accumulateurs
a)
Pile de Daniell
· matériau électrodes : Cu, Zn
· milieu ionique : H2O, Cu2+, Zn2+, SO42-
· réductions possibles :
· Cu2+/Cu E°1 = 0,34V
· H2O/H2 E°2 = 0 V
· Zn2+/Zn E°3 = -0,76 V
· oxydations possibles :
· H2O/O2 E’°1 = 1,23 V
· Cu/Cu2+ E’°2 = +0,34 V
·

 Zn/Zn2+ E’°3
= -0,76 V
Zn/Zn2+ E’°3
= -0,76 V
![]() Cu2+ H2O Zn2+
Cu2+ H2O Zn2+

![]()
![]()
 Réductions : E° (V) +0,34 0
-0,76
Réductions : E° (V) +0,34 0
-0,76
Oxydations : 1,23 +0,34 -0,76
H2O Cu Zn
La réduction de l’eau par oxydation du zinc étant très difficile cette réaction n’est pas prise en considération.
· Couplage : Cu2+ + 2e Cu E°1 = +0,34V
Zn Zn2+ + 2e E°3 = -0,76V
Réaction globale : Cu2+ + Zn ® Cu + Zn2+ DE° = +1,10V
- + Zn Cu ZnSO4 CuSO4
DG°R = -2´1,10´96500/1000 = -212,3kJ
·
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Réalisation pratique :
Réalisation pratique :
b)
Pile de alcaline
· matériau électrodes : graphite (C)/MnO2 , Zn
· milieu ionique : H2O, KOH
· réductions possibles :
· MnO2/MnO(OH) E°1 = 1,13 V
· H2O/H2 E°2 = 0 V
· oxydations possibles :
· H2O/O2 E’°1 = 1,23 V
·

![]()
 Zn/Zn2+
Zn/Zn2+![]() E’°2
= -0,76V
E’°2
= -0,76V
 MnO2 H2O
MnO2 H2O

![]() Réductions : E° (V) 1,13 0
Réductions : E° (V) 1,13 0
Oxydations : 1,23 -0,76
H2O Zn
La réduction de l’eau par oxydation du zinc étant très difficile cette réaction n’est pas prise en considération.
· Couplage : MnO2 + H+ + e MnOOH E1 = 1,13 – 0,059.pH (V)
Zn Zn2+ + 2e E’°2 = -0,76V
Réaction globale : 2MnO2+ Zn +2H+ ® 2MnOOH + Zn2+ DE = +1,89 – 0,059.pH (V)
· Réalisation pratique :
Il s’agit d’une pile de type discontinue, celle-ci étant inutilisable lorsque les substances réactives sont épuisées (MnO2 et Zn).
On peut calculer la relation entre la capacité de la pile (en Ah) et la quantité de MnO2 (MM = 86,93g/mol) disponible :
![]()
![]() (Ah) p étant la masse de MnO2
(Ah) p étant la masse de MnO2
c)
Pile de Mallory
· matériau électrodes : Métal/Ag2O, Zn
· milieu ionique : H2O, KOH
· réductions possibles :
· Ag2O /Ag E°1 = +1,17 V
· H2O/H2 E°2 = 0 V
· oxydations possibles :
· H2O/O2 E’°1 = 1,23 V
·
Zn/Zn2+![]() E’°2 =
-0,76V
E’°2 =
-0,76V


![]()
 Ag2O H2O
Ag2O H2O

![]() Réductions : E (V) 1,17 0
Réductions : E (V) 1,17 0
Oxydations : 1,23 -0,76
H2O Zn
La réduction de l’eau par oxydation du zinc étant très difficile cette réaction n’est pas prise en considération.
· Couplage : Ag2O + H2O + 2e 2Ag + 2OH- E1 = 1,17 – 0,059.pH (V)
Zn Zn2+ + 2e E3 = -0,76V
Réaction globale : Ag2O + Zn + H2O ® 2Ag + Zn2+ + 2OH- DE = +1,93 – 0,059.pH (V)
·
+
Réalisation pratique :
- Zn![]()
![]()
![]()
![]()
![]() Electrolyte
Electrolyte
![]() Ag2O
Ag2O
Il s’agit d’une pile de type discontinue, celle-ci étant inutilisable lorsque les substances réactives sont épuisées (MnO2 et Zn).
d)
L’accumulateur au plomb
· matériau électrodes : Pb/PbO2, Pb
· milieu ionique : H2O, H2SO4
· réductions possibles :
· PbO2/Pb2+ E°1 = 1,468 V
· H2O/H2 E°2 = 0 V
· oxydations possibles :
· H2O/O2 E’°1 = 1,23 V
·

![]()
 Pb/Pb2+
Pb/Pb2+![]() E’°2
= -0,125V
E’°2
= -0,125V
 PbO2 H2O
PbO2 H2O

![]() Réductions : E° (V) 1,468 0
Réductions : E° (V) 1,468 0
Oxydations : 1,23 -0,125
H2O Pb
La réduction de l’eau par oxydation du plomb étant très difficile cette réaction n’est pas prise en considération.
· Couplage : PbO2 + 4H+ + 2e « Pb2+ + 2H2O E1 = 1,468 – 0,118.pH – 0,295.log[Pb2+] (V)
Pb « Pb2+ + 2e E’2 = -0,125 + 0,295.log[Pb2+] (V)
Réaction globale : PbO2+ Pb +4H+ ® 2Pb2+ + 2H2O
Avec DE = +1,59 – 0,118.pH –0,059. log[Pb2+] (V)
Etant donné le milieu sulfurique, le plomb précipite sur les électrodes sous forme de PbSO4 :
2Pb2+ + 2 SO42- PbSO4 avec KS = 1,6.10-8 = [Pb2+][SO42-]
La concentration en acide étant élevée (4 mol/dm3), la concentration en SO42- est de 4M et celle en H+ de 8M. On en déduit la concentration en Pb2+ = 1,6.10-8/4 = 0,4.10-8M et un pH de –0,9 et DE = 2,2V.
·
- +
 Réalisation pratique :
Réalisation pratique :
 H2SO4
H2SO4
![]()
![]()

![]()
Pb
PbO2
PbSO4
L’accumulateur au plomb est un système réversible :
· En cours de décharge, les substances actives (PbO2 et Pb) sont consommées et il y a formation de PbSO4 sur les deux électrodes.
· Au cours de la charge, l’accumulateur est alimenté par un générateur de courant, les réactions sont inversées et les substances actives sont reformées.
e)
Les piles continues (piles
à combustible)
· matériau électrodes : métaux inertes (type Pt)
· milieu ionique : H2O, KOH
· réductions possibles :
· O2/H2O E°1 = 1,23 V
· oxydations possibles :
· H2/H2O E’°1 = 0 V

 O2 H2O
O2 H2O

![]() Réductions : E° (V) 1,23 0
Réductions : E° (V) 1,23 0
Oxydations : 1,23 0
H2O H2
· Couplage : O2 + 4H+ + 4e 2H2O E1 = 1,23 – 0,059.pH (V)
H2 2H+ + 2e E’1 = -0,059.pH (V)
Réaction globale : H2 + 1/2O2 ® H2O
Avec DE = +1,23 (V) et DGR = -2´1,23´96500/1000 = -237,4kJ
On réalise en fait une réaction de type combustion de l’hydrogène dans l’oxygène, mais les deux demi-réactions sont séparées.
·
- +
![]()
![]() Réalisation pratique :
Réalisation pratique :

![]()
![]()

![]() H2 ® ¬ O2
H2 ® ¬ O2
![]()
![]()
![]()
KOH
![]()
diaphragme
Les réactions se déroulent sur les deux électrodes poreuses recouvertes de catalyseurs.
On peut calculer l’énergie électrique qui peut être fournie à partir d’un Nm3 d’hydrogène avec une tension aux bornes de 0,9V et un rendement de 90% :
![]()
![]()
1 Nm3de H2 contient 1000/22,4 = 44,64 moles, soit 89,28 grammes de H2
On en déduit :
![]() Ah
Ah
La différence de potentiel étant de 0,9V, la quantité d’énergie électrique fournie est de :
2153.0,9 = 1938 Wh, soit 1,94 kWh
L’hydrogène peut être remplacé par d’autres combustibles :
• méthanol : CH3OH + 6OH- CO2 + 5H2O + 6e
• hydrocarbure : C8H18 + 16H2O 8CO2 + 50H+ + 50e
• ammoniac : 2NH3 + 6OH- N2 + 6H2O + 6e
• hydrazine : NH2NH2 + 4OH- N2 + 4H2O + 4e
Ces réactions sont donc à combiner avec la réduction de O2.
Pour les piles continues, les matières actives sont alimentées en continu, tandis que les produits de réaction doivent être éliminés.
2) Electrolyseurs
a)
Electrolyse d’une solution aqueuse de Na2SO4
· matériau électrodes : métaux inertes (type Pt)
· milieu ionique : H2O, KOH
· réductions possibles :
· H2O/H2 E°1 = 0 V
· oxydations possibles :
· H2O/O2 E’°1 = 1,23 V

 H2O
H2O

![]() Réductions : E° (V) 0
Réductions : E° (V) 0
Oxydations : 1,23
H2O
· Couplage : 2H2O O2 + 4H+ + 4e E1 = 1,23 – 0,059.pH (V)
2H+ + 2e H2 E’1 = -0,059.pH (V)
Réaction globale : H2O ® H2 + 1/2O2
Avec DE = -1,23 (V) et DGR = -2´1,23´96500/1000 = +237,4kJ
Il faut donc appliquer à l’aide d’un générateur externe une différence de potentiel supérieure à 1,23V pour que la réaction puisse se dérouler :
UAC = EA – EC + hA + |hC| +RI
·
- +
![]()
![]() Réalisation pratique :
Réalisation pratique :
![]()
![]()

![]() H2 ¬ ® O2
H2 ¬ ® O2
![]()
![]()
![]()
![]() Na2SO4
Na2SO4
![]()
diaphragme
Les compartiments anodique et cathodique doivent être séparés pour éviter la recombinaison de H2 et O2.
b)
Electrolyse d’une solution aqueuse de CuSO4
· matériau électrodes : métaux inertes (type Pb)
· milieu ionique : H2O, CuSO4
· réductions possibles :
· Cu2+/Cu E°1 = 0,34 V
· H2O/H2 E°2 = 0 V
· oxydations possibles :
· H2O/O2 E’°1 = 1,23 V

Cu2+ H2O


![]() Réductions : E° (V) 0,34 0
Réductions : E° (V) 0,34 0
Oxydations : 1,23
H2O
· Couplage : 2H2O O2 + 4H+ + 4e E°1 = 1,23 – 0,059.pH (V)
Cu2+ + 2e Cu E’°1 = 0,34 (V)
Réaction globale : Cu2+ + H2O ® Cu + 1/2O2 + 2H+
Avec DE = -0,89 + 0,059.pH (V) soit de l’ordre de -0,9V en solution acide
Il faut donc appliquer à l’aide d’un générateur externe une différence de potentiel supérieure à 0,9V pour que la réaction puisse se dérouler :
UAC = EA – EC + hA + |hC| +RI
·
- +
![]()
![]() Réalisation pratique :
Réalisation pratique :
O2

![]()
![]() CuSO4
CuSO4
![]()
Dépôt de Cu
c)
Electrolyse de raffinage du cuivre (anode Cu, solution aqueuse de CuSO4)
· matériau électrodes : anode en cuivre
· milieu ionique : H2O, CuSO4
· réductions possibles :
· Cu2+/Cu E°1 = 0,34 V
· H2O/H2 E°2 = 0 V
· oxydations possibles :
· Cu/Cu2+ E’°1
· H2O/O2 E’°2 = 1,23 V

Cu2+ H2O
![]()

![]() Réductions : E° (V) 0,34 0
Réductions : E° (V) 0,34 0
Oxydations : 1,23 0,34
H2O Cu
· Couplage : Cu Cu2+ + 2e E°1 = 0,34 (V)
Cu2+ + 2e Cu E’°1 = 0,34 (V)
Réaction globale : Cu2+ + Cu ® Cu +Cu2+
Avec DE = 0 (V)
Il faut donc appliquer à l’aide d’un générateur externe une différence de potentiel supérieure à 0V pour que la réaction puisse se dérouler :
UAC = EA – EC + hA + |hC| +RI
·
- +
![]()
![]() Réalisation pratique :
Réalisation pratique :

![]()
![]()
![]() CuSO4
CuSO4
![]()
![]()
Cu2+
Dépôt
de Cu
![]() Dissolution
du Cu
Dissolution
du Cu
L’anode de cuivre impur se dissout, de même que tous les métaux moins nobles que le cuivre (potentiels < 0,34), alors que les métaux précieux (potentiels > 0,34) se retrouvent à l’état métallique au fond de la cuve.
A la cathode, seul le cuivre se dépose puisque les métaux plus nobles susceptibles de se déposer avant le cuivre ne sont pas en solution.
d)
Electrolyse d’une solution aqueuse de NaCl
· matériau électrodes : métaux inertes (type Pt)
· milieu ionique : H2O, NaCl
· réductions possibles :
· H2O/H2 E°1 = 0 V
· Na+/Na E°2 = -2,71 V
· oxydations possibles :
· H2O/O2 E’°1 = 1,23 V
· Cl-/Cl2 E’°2 = 1,36 V

 H2O Na+
H2O Na+
![]()

![]() Réductions : E° (V) 0 -2,71
Réductions : E° (V) 0 -2,71
Oxydations : 1,36 1,23
Cl- H2O
L’oxydation de l’eau est plus lente que celle du chlore.
· Couplage : 2Cl- Cl2 + 2e E°2 = 1,36 (V)
2H+ + 2e H2 E’1 = -0,059.pH (V)
Réaction globale : 2NaCl + 2H2O ® H2 + Cl2 + 2NaOH
Avec DE = -1,36 + 0 ,059.pH (V)
·
- +
![]()
![]() Réalisation pratique :
Réalisation pratique :
![]()

![]()

![]() H2 ¬
® Cl2
H2 ¬
® Cl2
![]()
![]()
![]()
![]() NaCl
NaCl
![]()
diaphragme
Les compartiments anodique et cathodique doivent être séparés pour éviter la recombinaison de H2 et Cl2.