- 100 g oldatban van
140 : 40 = 100 : x
x = 28,57 g cukor és
100 - 28,57 = 71,43 g víz.
Az oldat tehát 28,57% cukorból és 71,43% vízbol áll. - 1 g oldatban 0,2857 g cukor és 0,7143 g víz van, tehát a cukor tömegtörtje 0,2857, a vízé 0,7143.
- 140 g oldatban a cukor és a víz moljainak száma:
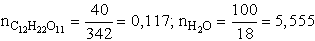
Tehát 0,117 + 5,555 = 5,672 mol oldat 0,117 mol cukrot tartalmaz. 100 mol oldat pedig:
5,672 : 0,117 = 100 : x
x = 2,062 mol% cukor
- 100 g víz 0,117 mol cukrot tartalmaz, 1000 g víz pedig
100 : 0,117 = 1000 : x
x = 1,17 mol/kg víz. - 140 g oldat térfogata V =
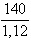 = 125 ml
= 125 ml
125 ml oldatban 0,117 mol cukor van oldva. 1000 ml-ben tehát
125 : 0,117 = 1000: x
x = 0,936 M
100 g, azaz 0,612
+ 2,222 = 2,834 mol oldat 0,612 mol H3PO4-at tartalmaz.
- 1 mol oldat tartalmaz tehát:
2,834 : 0,612 = 1 : x
x = 0,2159
- 100 mol oldat pedig:
2,834 : 0,612 = 100 : x
x = 21,59 mol% H3PO4
- 40 g víz 0,612 mol H3PO4-at tartalmaz, 1000 g víz pedig:
40 : 0,612 = 1000 : x
x = 15,3 mol H3PO4/kg víz
- 100 g oldat térfogata:
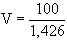 = 70,12 ml
= 70,12 ml
70,12 ml oldatban 0,612 mol H3PO4 van oldva, tehát 1000 ml-ben
70,12 : 0,612 = 1000 : x
x = 8,728 M
90,1
: 20 = 500 : x
x = ![]()
Tehát 500 ml 20%-os oldatban 111 g foszforsav van. Most kiszámítandó, hogy a
kereskedelmi 60%-os 1,43 g/ml sűrűségű foszforsav hány ml-ében van 111 g, és ezt a
mennyiséget kell felhígítani 500 ml-re. 100 g-ban van 60 g foszfor, ennek térfogata ![]() ml, ebben a
térfogatban 60 g foszforsav van.
ml, ebben a
térfogatban 60 g foszforsav van.
69,9 : 60 = x : 111
x = ![]() = 129,3 ml
60%-os foszforsav.
= 129,3 ml
60%-os foszforsav.
Ezt a 129,3 ml 60%-os foszforsavat kell hígítanunk 500 ml-re, hogy 500 ml 20%-os savat kapjunk.
1072,9 : 72,9 = 1000 : x
x = 67,94 g sósavat és
1000 - 67,94 = 932,06 g vizet tartalmaz.
1 kg 1 mol/kg víz koncentrációjú oldat hasonló számítások alapján 35,16 g sósavat és 964,84 g vizet tartalmaz. A két oldat elegyítésével keletkező oldat 67,94 + 35,16 = 103,10 g sósavat és 932,06 + 964,84 = 1896,90 g vizet tartalmaz.
1000 g vízben oldott sósav tehát
1896,9 : 103,1 = 1000 : x
x = 54,35 g HCl/kg víz
A keletkező oldat Raoult-féle koncentrációja ![]()
164 g oldat 64 g KNO3-t tartalmaz
100 g oldat x g KNO3-t
x = ![]()
A 40 oC-on telített KNO3 oldat 39%-os.
60 oC-on 100 g víz + 111,0 g KNO3 = 211,0 g oldat
20 oC on 100 g víz + 31,2 g KNO3 = ![]() oldat
oldat
211 g 60 oC-on telített KNO3 oldatból tehát 20 oC-ra való lehűtés közben 79,8 g KNO3 vált ki. Akkor 500 g oldatból
211,0 : 79,8 = 500 : x
x = ![]() g
g
500 g 60 oC-on telített KNO3 oldatból 20 oC-ra való lehülése közben tehát 189,1 g KNO3 vált ki.
- 60 oC-on 100 g víz 14,8 g bórsavat old. Akkor x g víz 15 g-ot. Innen x = 101,35 g
- 20 oC-on 100 g víz 5 g bórsavat old. Akkor
101,35 g víz y g bórsavat.
y = 5,07 g
Tehát kiválik 9,93 g (I. frakció) — 66%.
- 60 oC-on kereken 204 g vízben van 15 g anyag.
20 oC-on 100 g vízben 5 g anyag lehet oldva. Tehát
204 g vízben z = 10,2 g.
Tehát kiválik 4,8 g szűrési veszteség nélkül.
20% veszteséggel számolva: 3,84 g.
- 204 g vízben maradt 10,2 g bórsav
100 g víz 60 oC-on 14,8 g bórsavat oldat
w g víz 60 oC-on 10,2 g-ot. Innen
w = 68,92 g víz, tehát 204-68,9 = 135,1 g vizet kell elpárologtatni.
- Az anyaglúgban 10,2 g ortobórsav maradt oldva. Mivel
14,8 g-ból 14,8-5 = 9,8 g válik ki, így
10,2 g-ból q = 6,75 g válik ki.