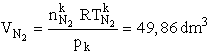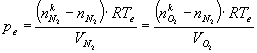A "normál körülmények" 0 oC-t és 101,325 kPa nyomást jelentenek. Az egyesített gáztörvényt alkalmazva:
![]()
![]() = 362,16 cm3
= 362,16 cm3
Megjegyezzük, hogy természetesen ugyanehhez az eredményhez jutunk, ha mindkét nyomást a régebben használatos Hgmm-ben vagy atm-ban helyettesítjük be.
T1 = T2
A palackban maradó gáz az eredeti gázmennyiségnek 75%-a, amely a palack térfogatának 75%-át foglalta el. Eszerint a gáz kezdeti állapotának állapothatározói:
p1 = 16,2 MPa
V1 = 0,75 V, ahol V = a palack térfogata
T1 = 300 K
Végállapotának állapothatározói:
p2 = ?
V2 = V
T2 = 280 K
Az egyesített gáztörvény szerint:
p2 = 11,34 MPa
Az általános gáztörvényt alkalmazva a kezdeti és a végállapotra:
![]()
![]()
![]()
![]() = 23,9435 g
= 23,9435 g
Ha a térfogatot literben (dm3-ben), a nyomást pedig kPa-ban helyettesítjük be a Dm képletébe, akkor R értéke 8,314, minthogy a korábbiakban láttuk, hogy R = 8,314 N· m/K· mol, a Pa-ról a kPa-ra való áttérés 10-3-nal való szorzást, a m3-rol a dm3-re való áttérés pedig 103-nal való szorzást jelent, tehát R értéke nem változik. A korábban használatos nyomásegységben (atmoszférában) kifejezett nyomást behelyettesítve, az R = 0,082 l· atm/K· mol értékkel kell számolnunk.
Az egyesített gáztörvény segítségével kiszámíthatjuk az új körülmények között a gáz térfogatát.
![]()
D V = 950 l
Tehát egy 950 l űrtartalmú tartállyal kell a palackot összekötni.
t = 163,58 oC
a.) Avogadro törvényét alkalmazva:
gramm-moltömegű (molnyi) gáz térfogata normál körülmények között 22,414 l. Tehát:
28 g nitrogén 22,414 l térfogatú
x g nitrogén 1 l térfogatú
x =
b.) Az általános gáztörvényt alkalmazva:
Mindkét állapotra az általános gáztörvényt alkalmazva
![]() = 51,26 kPa
= 51,26 kPa
Avogadro törvénye alapján gázok relatív sűrűsége (dr) moltömegük arányával kifejezhető:
![]()
![]()
![]() ;
; ![]() ;
; ![]()
![]() ;
; ![]() ;
; ![]() .
.
Minthogy mólnyi gáz normál térfogata 22,414 liter, egyszerű aránypárral
kiszámítjuk a fenti gázok normál litertömegét.
![]() = 1,25 g;
= 1,25 g; ![]() = 1,52 g;
= 1,52 g; ![]() = 1,96 g;
= 1,96 g; ![]() = 3,17 g:
= 3,17 g:
![]() = 2,85 g;
= 2,85 g; ![]() = 1,34 g;
= 1,34 g; ![]() = 2,05 g.
= 2,05 g.
Az általános gáztörvényt alkalmazva:
![]()
![]()
M = 4,03, tehát He-ról van szó.
Dalton törvénye értelmében a gázelegy össznyomása a komponensek parciális nyomásaiból additíve tevődik össze:
A gázelegy valamennyi komponensére érvényes a
pö · Vi = Vö · pi
összefüggés, vagyis
![]() , ahol
, ahol ![]() a térfogattört.
a térfogattört.
Tehát ![]() = 0,34,
= 0,34, ![]() = 0,66
= 0,66
A térfogattört a térfogatszázalék század része, így a gázelegy
összetétele a következő:
34 (V/V)% NO és 66 (V/V)% NO2.
Mivel a gázok esetében a térfogattört megegyezik a moltörttel, a parciális nyomást a következőképpen is kifejezhetjük:
![]()
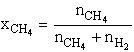
![]()
![]() kPa
kPa
A nitrogén parciális nyomása
A példa megfogalmazásából kitűnik, hogy izobar körülményt tartunk fenn. Felírhatjuk a kezdeti és a végállapotban a komponensek parciális nyomásait kezdeti állapotban:
![]()
![]()
végállapotban:
![]()
![]()
A két gáz parciális nyomása úgy aránylik egymáshoz, mint molszámaik (ld. Dalton
és Amagat szabály).
Kezdeti állapotban: 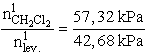
Végállapotban: 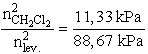
A két egyenletet egymással elosztva megkapjuk, hogy az eredeti metilén-klorid hányad
része marad a lehűtés után a gázelegyben.
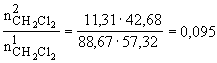
![]() = 0,095
= 0,095 ![]()
Tehát az elegyben 9,5% metilén-klorid marad vissza és 90,5% nyerhető vissza. A
kérdés 10 m3 elegyből visszanyerhető anyag mennyiségére vonatkozott. Meg
kell tehát határoznunk, hogy 10 m3 elegyben hány mol metilén-kloridunk van.
Az egyetemes gáztörvény összefüggését alkalmazva kapjuk:
![]() =
= ![]() = 231,23 mol
= 231,23 mol
Ennek 90,5%-a visszanyerhető:
![]() = 209,26 mol, ill. a moltömeggel
szorozva
= 209,26 mol, ill. a moltömeggel
szorozva
![]() = 209,26· 85
= 209,26· 85
![]() = 17787,1 g = 17,79 kg CH2Cl2
nyerhető vissza 10 m3 levegőből hűtéssel.
= 17787,1 g = 17,79 kg CH2Cl2
nyerhető vissza 10 m3 levegőből hűtéssel.
a.) A tökéletes gáz közelítés alapján:
![]()
Ilyen nagy nyomáson azonban a tökéletes gáz közelítés nem ad megfelelő eredményt. Valóban, a mérés alapján a nyomás 5,06 MPa. Ebben az esetben már nem tekinthetünk el a részecskék közötti kölcsönhatástól és a részecskék saját térfogatától sem.
b.) Vizsgáljuk meg, milyen eredményt kapunk a van der Waals egyenlet alapján.
![]() , ahol
, ahol
a = 3,648· 105 l2 · Pa/mol2
b = 0,0428 l/mol
![]()
Látható, hogy a méréssel való egyezés lényegesen jobb.
104,33 kPa
33,2 l O2 , 44,83 l N2, 5,6 l l SO2, 7,47 l NO, 3,2 l CO, 5,6 l CO2, 224,14 l H2, 44,83 l Cl2
1/5 részt kell kiengedni, 192,78 kPa
2,837 MPa
1/20 részt kell kiengedni, 192,78 kPa
a gáz hőmérséklete háromyszorosára nő.
1,963 g/l C3H8,0,714 g/l CH4,3,476 g/l AsH3,4,6397 g/l SiF4, 5,706 g/l HI
20,17 ; 20,17 ; 20,18
254,1 g/mol
135 g/mol ; S2Cl2
2,244 ; 2,700 g/l
S6
1,628 g/l
6,02·1021
21,28 kPa ;28,84 g/mol
106,65 kPa ; pO2=26,66 kPa ; pCH4=79,99 kPa
99,97 kPa
83,2 kPa
101,17 kPa
10,21 MPa
0,881 g/l
133,6 g/mol
pO2=47,00 kPa
M=6,65 g/mol ; 66,7% H2, 33,3 tf% CH4 , 20% H2, 80% CH4 , Sr=0,229
A Van der Waals egyenlet állandói a kritikus állapot jellemzőinek segítségével nyerhetők a következő összefüggés alapján:
ahol pK és vk a a kritikus állapothoz tartozó nyomás, illetve térfogat
pK = 4,56 MPa; Vk = 271,210-6 dm3; a = 1,006 Pa dm6, b = 9,0410-5 dm3
- A felmelegítés után a gáz összmolszáma a levegő és a kámfor moljainak összege.
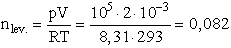 ,
, 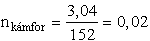
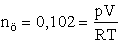 —
— 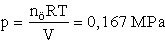
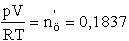 nkámfor
= nö-nlev. = 0,1017
nkámfor
= nö-nlev. = 0,1017
mkámfor = 152·0,1017 = 15,46 g
M=44,03 g/mol C2H4O
pSO2=58,2 Pa ; mSO2=1,4778 g
96,6%-a van cseppfolyós állapotban
Nem távozik levegő
15,27%-al csökken a lufi térfogata
44 g
900 kPa-ig használható
8,328 MPa
5,73 m3
386,2 kPa
16,4% O2, 61,6% N2, 22% H2
Tekintve, hogy a tökéletes gáztörvény szempontjából mind a négy gáz azonos módon viselkedik - a gáztörvény független az anyagi minőségtől - csak az összmolszám érdekes. Ezért a reakcióegyenlet lényege
2 mol folyadékból (nitropentaeritritbol, vagy röviden nitropentából) 25 mol gáz
lesz, azaz
nf : ng = 2 : 25, 25 nf = 2 ng
Gáztörvénybe helyettesítve: ![]() , továbbá
, továbbá
![]() 25 d =
25 d = ![]() p =
p = ![]()
![]() = 1731,6·106 Pa = 1732 Mpa
= 1731,6·106 Pa = 1732 Mpa
86,87 g
Kezdetben: