A toluol moltörtje: xT = 1 - 0,2 = 0,8
x = Dp / p° = 0,173 / 3,173 = 0,0545
| Ha 25 g-ot | oldottunk | 200 g | oldószerben, akkor | ||
x g-ot |
" |
1000 g | " |
||
x = 125 g/1000g oldószer
Tehát D T = 77,4 - 76,8 = 0,6 °C és
M = D TM / D T ·g = 1045,8 g/mol
- Az oldat ozmózisnyomása egyenesen arányos a mol/l koncentrációval. A naftalin oldat koncentrációja 3,9× 10-2 mol/l, az antracén oldat koncentrációja 2,81× 10-2 mol/l, ebből következik, hogy a naftalin oldat ozmózisnyomása nagyobb érték.
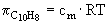 = 3,9× 10-2× 8,314× 298,16 = 96,68 kPa
= 3,9× 10-2× 8,314× 298,16 = 96,68 kPa
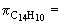 2,81× 10-2× 8,314× 298,16 = 69,66 kPa
2,81× 10-2× 8,314× 298,16 = 69,66 kPa
Tehát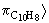
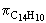
| p = cm× R× T | cm = |
p = 253 Pa = 0,253 kPa cm = 1,05× 10-4 mol/l
T = 290,16 K
c = 10 g/l
c = M× cm
M = ![]() = 9,52×
104 g/mol
= 9,52×
104 g/mol
c = M× cm = 109× 1,56× 10-2 =1,700 g/l
Tehát 998,3 g oldószerben 1,700 g o-amino-fenol van oldva, így az oldhatósága 0,1703 g/100 g oldószer.
![]() x =
x = ![]() ; (oa: oldott anyag)
; (oa: oldott anyag)
![]() = 61,89 g
= 61,89 g
M = 75 ![]()
D TM = 1,86 °C
g = 15,2 g/1000 g H2O D T = 0,377 °C
g = ![]() = 11,2 g/1000 g CS2
= 11,2 g/1000 g CS2
M = ![]() = 256,48 g
= 256,48 g
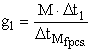
![]() =
1,86 °C
=
1,86 °C 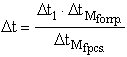
![]() = 0,16 °C
= 0,16 °C
p ö = x1p 1 + x2p 2
p ö = 0,25× 283,7 + 0,75× 141,9 = 177,35 kPa
![]()
p = 0,3·12,76 + 0,7·5,85 = 7,92 kPa
lesz az elegy fölött az össznyomás. A gőzösszetételt Dalton törvényéből számolhatjuk:
![]() Behelyettesítve:
Behelyettesítve: ![]()
ye = 51,67%
A 10 kPa nyomáson forró elegy összetételét szintén a Raoult törvényből számíthatjuk:
10 = x·12,76 + (1-x)·5,85 ® x = 0,6002
tehát 60% metanolt tartalmazó elegy forr 20 °C-on, 10 kPa nyomáson.