A többkomponensű homogén (egyfázisú) rendszereket oldatoknak és elegyeknek nevezzük. Elegyekről akkor szoktunk beszélni, ha a komponensek mennyisége azonos nagyságrendű, oldatokról pedig akkor, ha az egyik komponens (oldószer) mennyisége nagy a másikéhoz (az oldott anyagéhoz) képest. Híg oldatoknál ez az eltérés több nagyságrendet tesz ki. Oldatok és elegyek léteznek szilárd, cseppfolyós és gázállapotban. Gázok esetén általában elegyekről beszélünk. Gyakorlatban legfontosabbak a folyékony oldatok.
Az oldatokkal kapcsolatban új állapothatározót kell bevezetnünk, ez az oldat egyes komponensei relatív mennyiségeinek kifejezésére szolgáló koncentráció, mely az oldatok vagy elegyek összetételének megadására szolgál.
Az i-edik anyag koncentrációja alatt az illető komponens mennyiségét értjük az elegy egy adott mennyiségében. A koncentráció tehát az oldott anyag és az oldat mennyiségének a hányadosa. Az oldott anyag és az oldat mennyiségét megadhatjuk tömegükkel, molszámukkal vagy esetleg térfogatukkal is, ennek megfelelően a legkülönbözőbb koncentráció-egységeket definiálhatjuk.
Ha az oldott anyag és az oldat mennyiségét egyaránt tömegükkel adjuk meg,
nyerjük a tömegtörtet. A tömegtört megadja az illető anyag tömegét az oldat
egységnyi tömegében:![]() , ahol mi az i-edik anyag tömege. A tömegtört
százszorosa a tömegszázalék, ami az illető anyag grammjainak száma 100 g
oldatban. A tömegszázalékot (m/m)%-kal, vagy egyszerűen %-kal jelöljük. A
tömegtört összege 1-gyel, a tömegszázaléké pedig 100-zal egyenlő.
, ahol mi az i-edik anyag tömege. A tömegtört
százszorosa a tömegszázalék, ami az illető anyag grammjainak száma 100 g
oldatban. A tömegszázalékot (m/m)%-kal, vagy egyszerűen %-kal jelöljük. A
tömegtört összege 1-gyel, a tömegszázaléké pedig 100-zal egyenlő.
Ha az oldott anyag és az oldat mennyiségét molszámukkal adjuk meg, a moltörtet
nyerjük (xi). Ennek százszorosa a molszázalék (Xi vagy
mol%). ![]()
A moltört és molszázalék kiszámításához ismernünk kell a komponensek
moljainak számát, vagyis a molszámot (n). Ezt úgy kapjuk meg, hogy az i-edik
komponens tömegét (mi) elosztjuk a komponens moltömegével (Mi),
vagyis: ![]()
Így pl. egy kétkomponensű rendszer esetében az 1. komponens molszázaléka: 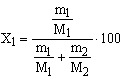
A moltört (x) különösen fizikai kémiai számításokkal kapcsolatban fordul elő.
Valamely oldat egyik komponensének moltörtjét úgy kapjuk
meg, hogy az illető komponens moljainak számát elosztjuk az oldatban jelen levő
valamennyi komponens moljainak a számával. Ha az oldat két komponensből áll, akkor az
x1, x2 moltörtek :![]()
A moltörtek összege 1-gyel: ![]() xi = 1, a molszázalékoké 100-zal egyenlő. A
moltörtekből a megfelelő tömegtörtek a komponensek molekulatömegeinek ismeretében
kiszámíthatók:
xi = 1, a molszázalékoké 100-zal egyenlő. A
moltörtekből a megfelelő tömegtörtek a komponensek molekulatömegeinek ismeretében
kiszámíthatók: ![]()
Tehát összefoglalóan a moltört (x) az oldat egyik komponense moljainak száma az oldat 1 moljában, a molszázalék (X) pedig megadja, hogy az oldat 100 moljában (oldószer molszáma + oldott anyag molszáma) az oldott anyag hány molja van feloldva. Pl. X = 20 molszázalékos oldatban 20 mol oldott anyag és 80 mol oldószer van.
Hasonlóképpen definiálhatók a térfogattört és térfogatszázalék
is. Ezeknek azonban csak akkor van értelme, ha a komponensek elegyítésekor nem lép
fel térfogatváltozás. Ez a helyzet tökéletes gázok elegyeinek esetében: V=![]() Vi ahol Vi az i-edik gáz térfogata az elegy
hőmérsékletén és nyomásán. Gázok esetében a térfogatszázalék megegyezik a
molszázalékkal, ezért a gázok összetételét általában térfogatszázalékban
szokás megadni. Tehát a térfogatszázalék megadja, hogy az oldat (ill. elegy) 100
térfogategysége az adott komponens hány térfogategységnyi mennyiségét tartalmazza,
pl. 70 V/V-os oldat 100 ml-e 70 ml oldott anyagot tartalmaz. A térfogatszázalék jele
(V/V)%.
Vi ahol Vi az i-edik gáz térfogata az elegy
hőmérsékletén és nyomásán. Gázok esetében a térfogatszázalék megegyezik a
molszázalékkal, ezért a gázok összetételét általában térfogatszázalékban
szokás megadni. Tehát a térfogatszázalék megadja, hogy az oldat (ill. elegy) 100
térfogategysége az adott komponens hány térfogategységnyi mennyiségét tartalmazza,
pl. 70 V/V-os oldat 100 ml-e 70 ml oldott anyagot tartalmaz. A térfogatszázalék jele
(V/V)%.
A térfogatkoncentrációk vagy parciális sűrűségek
esetén az oldat mennyiségét annak térfogatával adjuk meg. Az oldott anyag
mennyiségét kifejezhetjük annak tömegével vagy moljainak számával. Ha minden
komponens koncentrációját pl. az 1 liter oldatban levő grammok számával adjuk meg,
akkor ezek összege az oldat sűrűségét szolgáltatja g/liter egységben: ![]() ahol ma az
oldott anyag mennyisége grammban, V az oldat térfogata literben.
ahol ma az
oldott anyag mennyisége grammban, V az oldat térfogata literben.
A vegyesszázalék megadja, hogy az oldat (vagy elegy) 100 térfogategységnyi mennyisége az oldott anyag hány tömegegységnyi mennyiségét tartalmazza, pl. 35 vegyesszázalékú oldat 100 ml-e 35 g oldott anyagot tartalmaz, azaz a térfogatkoncentráció tizedrésze. A laboratóriumi gyakorlat folyamán ezt a koncentrációt igen gyakran használjuk! Fontos még megjegyezni, hogy a vegyesszázalék tulajdonképpen nem százalék, mivel dimenziója van!
A térfogat-koncentráció (g/l)az oldat egy literében oldott anyag mennyisége g-ban. Pl. 50 gramm NaCl egy liter NaCl-oldatban.
A moláris koncentráció (jele cm vagy M - nem
tévesztendő össze az ugyancsak M-mel jelölt moltömeggel), illetve molaritás
("liter molaritás") az 1000 ml oldatban oldott anyag moljainak számát
jelenti. (A szakirodalomban gyakran a cm jelzés m index nélkül fordul elő.)
![]() , na az
oldott anyag moljainak száma, V az oldat térfogata literben.
, na az
oldott anyag moljainak száma, V az oldat térfogata literben.
A molaritás egysége: ![]()
Az "ekvivalens koncentrációról" később, az ún. normáloldatoknál lesz
szó.
A térfogat-koncentrációk az oldat hőkiterjedése következtében
változnak a hőmérséklettel. Alkalmazásuk ezért csak állandó hőmérséklet esetén
célszerű. A térfogat-koncentráció reciproka a higítás, mely annak az
oldatnak a térfogatával egyenlő, melyben egységnyi oldott anyag van. A molaritás
reciproka: ![]() az a
térfogat literben, amelyben egy mol oldott anyag található.
az a
térfogat literben, amelyben egy mol oldott anyag található.
Híg oldatok koncentrációját gyakran molalitásukkal (Raoult-féle
koncentrációval) adjuk meg. A molalitás az 1 kg (vagy 1000 g) oldószerben oldott
molok számát jelenti. Híg oldatok esetén a molalitás a molaritással arányos. Mivel
a molalitás nem térfogat-koncentráció, számértéke nem függ az oldat
hőmérsékletétől. (A molalitás jelölésére m betűt szokás használni, éppúgy,
mint a tömeg jelölésére.) ![]() , na az oldott anyag moljainak száma, m1 pedig az
oldószer tömege kilogrammban.
, na az oldott anyag moljainak száma, m1 pedig az
oldószer tömege kilogrammban.
A molalitás egysége: ![]()
A koncentrációk fenti kifejezésmódja mellett használatos még a híg oldatok törvényeivel kapcsolatos számításoknál (pl. krioszkópia, ebullioszkópia) az olyan koncentráció is, melynél az oldott anyag mennyiségét 1000 g oldószerben feloldott grammokban adja meg (g).
Összefoglalásképpen és emlékeztetőül álljon itt az alábbi táblázat a legfontosabb koncentráció-egységekkel.
koncentráció |
jelölés |
oldószer |
oldott anyag |
oldat |
tömeg% |
(m/m)%, % |
- |
g |
g |
térfogat% |
(V/V)% |
- |
l |
l |
molaritás |
M, cm |
- |
mol |
l |
molalitás |
m |
1000 g |
mol |
- |
moltört |
x |
mol |
mol |
Gyakran előforduló koncentrációk még:
![]() ;
; ![]() ;
; ![]() , ( = 10-6
g).
, ( = 10-6
g).
Az angolszász irodalomban előforduló ppm (part per million) jelölés azt jelenti, hogy 1 rész oldott anyag 106 rész oldószerben van oldva, a ppb (part per billion) jelölés pedig azt, hogy 1 rész oldott anyag 109 rész oldószerben van oldva.
Az oldódás lehet korlátlan, ha az oldott anyag az oldószerrel minden arányban elegyedik, pl. alkohol–víz, kénsav–víz stb., vagy részleges, mint pl. fenol–víz, cukor–víz, konyhasó–víz stb. Részleges oldódásnál telített oldat is keletkezhet, melynél az oldandó anyag külön fázisként is jelen van.
Az oldhatóság a telített oldat koncentrációja, amely függ az oldott anyag és az oldószer minőségétől, továbbá a hőmérséklettől is. Az egyes vegyületek vízben való oldhatóságát a hőmérséklet függvényében táblázatokban találjuk meg. Ezek az adatok általában a 100 g vízben oldható anyag grammokban kifejezett mennyiségét jelentik (7. táblázat), de található (m/m)%-ban is adat a szakirodalomban.
Kristályos anyagoknál ha a kristályvíztartalmat külön nem tüntetik fel – a táblázat adatai a kristályvízmentes (sicc.) anyagra vonatkoznak.