- Mennyi a víz 100 oC-on történő
elpárologtatásának moláris entrópia értéke? A víz párolgáshője 100 oC-on:
40,68 kJ/mol.
- A metán égésének egyenlete:
CH4(g) + 2 O2(g)
= CO2(g) + 2 H2O(g)
DG értéke: -817,9 kJ/mol 25 oC-on.
A fenti hőmérsékleten melyik irányba játszódik le
magától a reakció?
- A gyémánt grafittá történő átalakulásának szabadentalpiája: DG = -2,9 kJ/mol 25 oC-on. Ennek ismeretében bölcs dolog-e nagyértékű gyémántot vásárolni?
- Számítsuk ki az alábbi reakció normál szabadentalpia
értékét és becsüljük meg a reakció irányát;
CuO(sz) +
H2(g) = Cu(sz) + H2O(f)
- Számítsuk ki az alábbi reakciók DG0
értékét és becsüljük meg a folyamatok irányát.
- 2 CH3OH(f) + 3 O2(g) = 2 CO2(g) + 4 H2O(g)
- N2(g) + 3 H2(g) = 2 NH3(g)
- CaO (sz) + CO2(g) = CaCO3(sz)
- PbO2(sz) + 2 H2(g) = Pb(sz) + 2 H2O(g)
- CaSO4(sz) = CaO(sz) + SO3(g)
- ZnO(sz) + H2S(g) = ZnS(sz) + H2O(f)
- CH3COOH(f) + 2 O2(g) = 2 CO2(g) + 2 H2O(f)
- 2 H2O(f) + O2(g) = 2 H2O2(f)
- Számítsuk ki az alábbi reakció DG0 értékét
2 CO(g) + O2(g) = 2
CO2(g)
a következő két reakció DG0 értékének
ismeretében:
2 CH4(g) + 3 O2(g) = 2 CO(g) + 4 H2O(g)
D G0 = -1088 kJ
CH4(g) + 2 O2(g) = CO2(g) + 2 H2O(g) D
G0 = - 801 kJ
- Mennyi az Al2O3 képződési normál
szabadentalpiája, ha
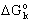 (Fe2O3)
= -742,2 kJ/mol és az alábbi reakció normál szabadentalpiája ismert?
(Fe2O3)
= -742,2 kJ/mol és az alábbi reakció normál szabadentalpiája ismert? Fe2O3(sz) + 2 Al(sz) = Al2O3(sz)
+ 2 Fe(sz)  = -840,1 kJ
= -840,1 kJ
- A H2 és O2 gáz fent említett reakciójának egyensúlyi
állandója rendkívül nagy érték. Mégis, ha O2 és H2 gázokat
egymással elegyítünk, nem figyelhető meg reakció, sot az elegy változásmentesen
hosszan eltartható. Magyarázza meg ezt a viselkedést!
- NOCl-t, NO-t és Cl2 gázt elegyítettünk 35 oC-on egy
tartályban. A következő reakció játszódott le és egyensúly állt be.
2 NOCl(g) Ű 2 NO(g) + Cl2(g)
Az alábbi egyensúlyi koncentrációkat mértük:
[Cl2] = 3,04·10-1 mol/dm3
[NO] = 8,00·10-3 mol/dm3
[NOCl] = 7,92·10-1 mol/dm3
Számítsuk ki Kc értékét!
- Az oxigént, Földünk egyik leggyakrabban előforduló elemét, iparilag cseppfolyós
levegőből állítják elő, frakcionált desztillációval. Laboratóriumi
előállítása sok esetben oxidok hőbontásával történik. Az
alábbi megadott oxidok közül válassza ki az erre legalkalmasabbat, és a
legkedvezőtlenebbet Kc ismeretében:
| 2 Al2O3 Ű 4 Al + 3 O2 |
Kc = 2× 10-551 |
| 2 KClO3 Ű 2 KCl + 3 O2 |
Kc = 2× 1040 |
| 2 HgO Ű 2 Hg + O2 |
Kc = 1,2× 10-22 |
(Az értékek szobahőmérsékletre vonatkoznak.)
- 2 mol "A" és 4 mol "B" jelű anyagot vezetünk egy üres, 1 dm3
térfogatú tartályba. Amikor az
A + 3 B Ű
2 C
reakcióegyenlet szerint elérjük az egyensúlyt, a palack 2 mol
"C" anyagot tartalmaz. Számítsa ki Kn
értékét!
- Hidrogén és jód gőzállapotban reagálva HI-t ad. A reakció egyensúlyi állapotát
mélyrehatóan tanulmányozták és 450 oC-on a Kc = 50,3 értéket
határozták meg. Számítsuk ki Kp értékét is!
- A következő egyenlet Kp értéke 800 K hőmérsékleten:
9× 102
2 SO2(g) + O2(g) Ű 2 SO3(g)
Adjuk meg Kc értékét!
- Számítsuk ki a metanol-szintézis Kp
egyensúlyi állandóját:
CO(g) + 2 H2(g) Ű CH3OH(g)
A kiindulási arány 1:2 (sztöchiometriai) CO és H2 esetében. 300 oC-on
a hidrogén 30%-a reagált. Az egyensúlyi nyomás 10,1 MPa.
- 870 K hőmérsékleten HCl és O2 gázok kémiai reakciója során 23,8 mol%
Cl2 gáz képződik a sztöchiometriai összetételű kiindulási
gázelegyből. Számítsuk ki az egyensúlyi parciális
nyomások értékét, további Kp, Kc, Kn és Kx
egyensúlyi állandók értékét, ha az egyensúlyi nyomás 0,101 MPa.
4 HCl + O2 Ű 2 Cl2 + 2 H2O
- A foszfor(V)-klorid – PCl5 – gőzfázisban foszfor(III)-klorid
keletkezése közben bomlik. Számítsuk ki a komponensek
egyensúlyi koncentrációit, ha Kc = 0,8 M 340 oC-on és a
kezdeti PCl5 mennyisége 0,12 mol volt az 1 dm3 térfogatú
palackban.
- Számítsuk ki az alábbi egyenletek Kp
értékeit. Az egyensúlyi állandó értékét a 13. példából
vegyük:
- 2 SO3(g)Ű2 SO2(g) + O2(g)
- 4 SO2(g) + 2 O2(g) Ű 4 SO3(g)
- SO2(g) + 1/2 O2(g) Ű SO3(g)
- 15 mol NO-t és 9 mol O2-t egy üres palackba vezetünk, majd a palackot
lezárás után 350 oC-ra hevítjük. Az egyensúly elérése után a palack
13,2 mol NO2-t tartalmaz. Számítsuk ki Kn
értékét! Határozzuk meg Kp értékét is, ha az egyensúlyi
össznyomás 0,3 MPa.
- Vizsgáljuk meg a következő reakciót:
H2(g) + F2(g) Ű 2 HF(g)
Kc = 115
Egy kísérlet során 3 mol H2-t és 6 mol F2-t elegyítünk egy 3
dm3 térfogatú tartályban. Számítsuk ki a
komponensek egyensúlyi koncentrációit!
- Egy 1 dm3 térfogatú tartályban a N2 és H2 gázok
parciális nyomása 200 K-on 10 kPa, ill. 50 kPa. Ha a gázelegyet 600 K hőmérsékletre
emeljük, a kiindulási anyagok egy részébol NH3 keletkezik. Számítsuk ki az egyensúlyi parciális nyomásokat, ha Kp
= 1,7.10-3!
- 2 g N2O4-t 70 oC-ra melegítünk, ekkor a gáz
térfogata 0,507 dm3 lesz 0,2 MPa nyomáson. Számítsuk
ki Kp értékét!
N2O4(g) Ű 2 NO2(g)
- 2 mol etanol és 3 mol ecetsav reakciója során etil-acetát és víz keletkezett. Számítsa ki a komponensek egyensúlyi moltörtjeit, ha Kx
= 4,0.
- Az előző reakciót Na2SO4 jelenlétében is - ez nedvszívó,
higroszkópos anyag - kiviteleztük. A víz mennyisége ezért egyensúlyban 0,01 molra
csökkent. Hány mol etil-acetát képződött így?
- Ha 2,2 g HI-t 500 K hőmérsékletre hevítünk, akkor egy része elbomlik és az
egyensúlyi elegyben 1,9 g HI lesz. Számítsa ki Kx értékét!
- 1400 K hőmérsékleten az alábbi egyensúlyi állandókat határozták meg:
H2(g) + Br2(g) Ű2
HBr(g) Kp = 6,7·104
H2(g) Ű 2 H(g) Kp = 2,96·10-11
Br2(g) Ű 2 Br(g) Kp =
3,03·10-2
Számítsa ki a következő disszociációs reakció Kp értékét!
HBr(g) Ű H(g) + Br(g)
- Vizsgáljuk meg az alábbi egyenletet!
N2O4(g) Ű 2 NO2(g)
Kc = 0,9 M 120 oC-on
Számítsuk ki a következő reakció Kc
értékét!
1/2 N2O4(g) ŰNO2(g)
- A következő reakció Kc értéke 2,5·1015 500 oC-on:
CO(g) + 1/2 O2(g) Ű CO2(g)
Számítsa ki Kp-t!
- A következő reakció Kp értéke 1,79.10-5 350 oC-on.
2 SO3(g) Ű 2 SO2(g) + O2(g)
Számítsa ki Kc értékét!
- Fejezzük ki Kp-t a következő reakció
disszociációfokának segítségével:
A2 Ű2 A
- 2 g N2O4(g) térfogata 70 oC-on és 0,2 MPa nyomáson
0,507 dm3, amikoris a következő egyensúly adható meg:
N2O4(g) Ű 2 NO2(g)
Számítsuk ki "Kn" és "a" értékét, továbbá az egyensúlyi átlag moltömeget!
- Egy molekula (M = 156 g/mol) 727 K hőmérsékleten és 42,546 MPa nyomáson
disszociál. Ilyen körülmények között a disszociációfok, a
= 0,09. Számítsuk ki, hány részecske képződik a reakció
folyamán, ha az egyensúlyi elegy sűrűsége 805 g/dm3.
- Számítsuk ki Kp-t a
segítségével a következő reakciókból:
- AB Ű 1/2 A2 + 1/2 B2
- 2 A2B Ű 2 A2 + B2
- AB Ű A + B
- 2 A3B Ű 3 A2 + B2
- Egy disszociációval járó reakció során az eredeti hexán 49%-a bomlik el 800 K
hőmérsékleten és 40,4 MPa nyomáson. Számítsuk ki az
egyensúlyi gázelegy sűrűségét:
C6H14(g)
Ű C3H8(g) + C3H6(g)
- A foszgén - COCl2 - (színtelen mérgező gáz, amelyet az
I. világháborúban harci gázként használtak) kezdeti koncentrációja egy 1 dm3
térfogatú tartályban 390 oC-on 0,015 mol. Az egyensúly elérésekor 20%
bomlott el CO-ra és Cl2-ra. Számítsuk ki Kc
értékét!.
COCl2 Ű CO + Cl2
- A foszgén 500 oC-on és 0,101 MPa nyomáson 67%-ban disszociál. Ha
változatlan nyomáson a hőmérsékletet 600oC-ra növeljük, a disszociáció
mértéke 91%-os lesz. Számítsuk ki a térfogatnövekedés
százalékos értékét. A reakcióegyenletet a 34. feladatból
vegyük.
- Ha az NH4Cl-t 0,101 MPa nyomáson 300 oC-ra hevítjük, az
egyensúlyi gázelegy sűrűsége 0,619 g/dm3 lesz. Hány
százalék NH4Cl bomlott el?
NH4Cl(g) Ű
NH3(g) + HCl(g)
- Számítsuk ki a disszociált HI gázelegy egyensúlyi
parciális nyomásait és a térfogatszázalékos összetételt. Kx =
1,4410-2 600 K hőmérsékleten és 0,505 MPa nyomáson. A bomlás az alábbi
reakció szerint megy végbe:
2 HI(g) Ű H2(g)
+ I2(g)
- Számítsuk ki a kalcium-karbonát bomlásának Kc
értékét, ha a CO2 parciális nyomása 35 kPa 600 K hőmérsékleten!
- A folyékony halmazállapotú víz "fizikai" egyensúlyban van a vízgőzzel. Számítsuk ki a Kp és Kc értékét a
víz forráspontján!
- A vízgáz reakció egyensúlyi állandója 1100 K hőmérsékleten Kp = 10. Adjuk meg a komponensek parciális nyomását a fenti
hőmérsékleten, ha az össznyomás 101,32 kPa!
C(sz) + H2O(g) Ű CO(g) + H2(g)
- Számítsuk ki a 0,02 mólos HCl oldatban a H3O+
koncentrációt!
- Számítsa ki a következő HCl oldatok pH értékeit:
10-4 M, 10-3 M, 10-2 M, 10-1 M és 1 M!
- Számítsa ki az alábbi NaOH oldatok pOH és pH értékeit:
10-4 M, 10-3 M, 10-2 M, 10-1 M és 1 M!
- Számítsa ki a 3·10-3 M H2SO4
oldat pH-ját!
- Számítsuk ki a 10-8 M HNO3 oldat
pH-ját!
- Számítsa ki a 10-10 M KOH oldat pH-ját!
- 25 cm3 0,2 M KOH és 45 cm3 0,1 M HClO4 oldatokat
elegyítünk, számítsuk ki az elegy pH-ját!
- Számítsa ki a 10-8 M NaOH oldat pH-ját!
- 50 cm3 2,00 pH-jú HCl és 50 cm3 1,75 pH-jú H2SO4
oldatokat öntünk össze. Számítsuk ki az új oldat
pH-ját!
- A tömény salétromsav (amely 960 g savat és 440 g vizet tartalmaz 1 dm3
térfogatban) csak részlegesen disszociál és disszociációfok, a
= 0,003. Számítsa ki a tömény HNO3 pH-ját!
- Az ecetsav disszociáció állandója Kc = 1,78.10-5. Számítsuk ki a 2 M ecetsav oldat pH-ját!
- Számítsuk ki a disszociációfokot
- 1 M HNO2
- 0,01 M HNO2 oldatok esetében!
Kc = 4·10-4
- A fluor-ecetsav, FCH2COOH, gyenge sav, disszociációs állandója Kc
= 2,6× 10-3. Mennyi a 2,7 pH-jú oldat
molaritása?
- Számítsa ki a 0,1 M NH3 oldat pH-ját. Az
ammónium-hidroxid gyenge bázis, Kc = 1,8·10-5.
- A klórossav - HClO2 - 0,1 M oldatának pH-ja 1,2. Számítsa ki a sav Kc értékét!
- A klór-ecetsav disszociáció állandójának értéke 1,4·10-3. Határozza meg
- a disszociációfokot 0,5 M oldat esetében,
- az oldat pH-ját,
- az oldat fagyáspontját, ha az oldat sűrűsége 1,1 g/cm3!
- Számítsa ki annak az ecetsav oldatnak a moltörtjét,
amelyből 15 g-ot 5 dm3-re higítva 3,2 pH-jú oldatot nyerünk!
- Mennyi a moltömege annak a gyenge savnak, amelynek 2,64
grammját 40 gramm vízben oldva 1,178 oC fagyáspontcsökkenést tapasztalunk.
A disszociációfok ismert, értéke a = 0,16.
- Számítsuk ki a 3·10-3 M kénsav oldat pH-ját,
ha a második disszociációs állandó Kc2= 1,2·10-2.
- Számítsuk ki a 0,1 M H2SO4 oldat
pH-ját, feltételezve:
- teljes disszociációt a második lépcsőben is,
- egyensúlyt tételezve fel a második lépcsőre.
- A H2S gáz telített vizes oldata 25 oC-on 0,1 M. Számítsuk ki a pH-t és az oldatban lévő különböző ionok
koncentrációját!
- Egy főzőpohárban desztillált vizet tárolunk levegőn, a
desztillált víz elnyeli a levegőben lévő szén-dioxidot és pH-ja 5,52 lesz. Számítsuk ki az oldat moláris CO2
koncentrációját, ha Kc1= 4·10-7, Kc2=
4·10-11.
62/a. Számítsa ki a szénsav első
disszociáció állandójának "valódi" értékét a 62.
feladatban megadott értékek alapján.
- Számítsa ki a 0,1 M foszforsav oldat pH-ját!
- Számítsa ki a SO42- és HSO4-
ionok koncentrációját, valamint a pH-t 0,5 M kénsavoldat esetében!
- Az acetátion az ecetsavból származtatott konjugált bázis. Számítsa ki az alábbi reakció Kb értékét:
CH3COO- + H2O Ű CH3COOH
+ OH-
Ismerjük az ecetsav Ka disszociációs állandóját: Ka = 1,78·10-5
- Állapítsuk meg a 0,05 M nátrium-acetát
oldat pH-ját!
- Számítsa ki a 0,01 M nátrium-benzoát oldat pH-ját, ha Ks
= 6,6·10-5!
- Adja meg a 0,1 M NH4Cl oldat pH-ját. Ks
értéke NH4+-ra 5,5·10-10!
- Mennyi a 0,5 M NaCN oldat pH-ja? Ks = 4·10-10
- 8,75 pH-jú vizes oldatot kell készítenünk úgy, hogy a felsorolt sók közül egyet
oldunk vízben. Melyik sót használjuk fel és mekkora lesz
az oldat molaritása? A rendelkezésre álló sók: NH4Cl, KHSO4,
KNO2, NaNO3.
- Elegyítsünk 150 cm3 0,2 M NaOH és 300 cm3 0,1 M ecetsav
oldatokat. Mekkora lesz a keletkező elegy pH-ja?
- 25 g NaOH-t 200 g 0,2 M benzoesav oldatban oldunk fel. A keletkezett elegy sűrűsége
1,05 g/cm3. Számítsuk ki az új oldat pH-ját!
- 20 g anilint (C6H5NH2, igen fontos vegyipari alapanyag,
mely vizes oldatban gyenge bázisként viselkedik) és 20 g 30%-os sósavat oldottunk fel
1 dm3 vízben szerves kémiai szintézis céljára. Az anilin a sósavval az
alábbi reakcióegyenlet szerint reagál:
C6H5NH2 +
HCl = C6H5NH3Cl
Számítsa ki az oldat pH-ját, ha d = 1,05 g/cm3 és
Kb = 2,34·10-5.
- 100 cm3 0,1 M NaOH oldatot reagáltattunk 100 cm3 0,3 M ecetsav
oldattal. Számítsa ki az elegy pH-ját!
- Adjuk meg annak a puffernek a pH-ját,
amely literenként 0,1 M NH4OH-t és 0,3 M NH4Cl-t tartalmaz.
Számítsuk ki a pH-t abban az esetben is, ha a pufferoldatot 10 literre higítottuk. Kc
= 1,78·10-5
- Egy HAc-NaAc pufferoldatban mindkét alkotó anyag koncentrációja 0,1 M. Adjunk 1 dm3
pufferoldathoz 20 cm3 2 M HCl oldatot. Határozzuk
meg a pufferoldat pH-ját a sósav oldat hozzáadása előtt és után!
- Adjunk 5 cm3 1 M HCl oldatot 100 cm3 0,1 M ecetsavhoz. Határozzuk meg a pH-t!
- Elegyítsünk 5 cm3 0,01 M HCl és 100 cm3 0,1 M HAc oldatot. Adjuk meg a keletkező elegy pH-ját!
- Egy hidrazin (N2H4, kétsavú bázis, Kc = 3,1·10-6)
és NH4OH elegy pH-ja 11,3. Számítsa ki az [NH4OH]-t,
ha [N2H4]=1 M!
- Mi lenne az ideális Ka érték a használt savra
egy 7,00 pH-jú pufferoldat készítéséhez,?
- Számítsuk ki a pH-ját egy
- 1,0 M HCN oldatnak,
- 1,0·10-4 M HCN oldatnak, ha Kc = 6,2·10-10
- Mi a benzoesav/nátrium-benzoát arány a belőlük
készített pufferoldat esetében, ha annak pH-ja 4,80?
- Számítsa ki a 0,4 M Na2SO3 oldat
pH-ját!
- Számítsa ki a 0,2 M Na2CO3 oldat
pH-ját!
- 50 cm3 0,6 M NH4Cl oldatba 30 cm3 0,4 M NaOH oldatot
öntöttünk. Számítsuk ki, hogy mennyi az így keletkezett
pufferoldat pH-ja!
- Mennyi lesz a pH-ja annak az oldatnak, amit úgy
készítünk, hogy 2,46 g nátrium-acetátot (M: 82,00) 100 cm3 0,1 M HCl-ben
oldunk? Tételezzük fel, hogy az oldat sürusége 1 g/ml.
- Számítsa ki egy 5 cm3 10-4 M
HCl-ból és 100 cm3 0,1 M HAc-ból álló elegy pH-ját!
- Elegyítsen hangyasav és 0,001 M salétromsav oldatokat 1:1 arányban! Határozza meg az eredeti hangyasav-koncentrációt, ha az
elegy pH-ja 2,7!
- Négy különböző oldat áll laboratóriumunkban rendelkezésre, hogy pufferoldatokat
készítsünk belőlük. Ezek:
| NH4Cl |
1,0 M |
| CH3COONa |
0,5 M |
| CH3COOH |
0,5 M |
| NH4OH |
0,2 M |
Milyen összetételben lehetne az alábbi pH értékű
pufferoldatokat elkészíteni?
- pH = 4,9
- pH = 9,85
- pH = 8,95
- Egy 0,5 M HCN oldat pH-ját két egységgel növelnünk kell. Ennek egyik módja az,
hogy NaCN-t adunk az oldathoz. Hány gramm NaCN-t kell 1 dm3
0,5 M HCN oldathoz adni? Tételezzük fel, hogy az NaCN oldásakor az oldat
sűrűsége nem változik.
- Adja meg a 0,01 M ammónium-acetát oldat pH-ját!
- Határozza meg annak az oldatnak a pH-ját, amelyik
hangyasavra és ecetsavra nézve is 0,5 M. Számítsa ki mindkét sav
disszociációfokát.
- Összeöntöttünk 1 dm3 0,1 M KH2PO4 és 1 dm3
0,1 M K2HPO4 oldatot. Mennyi az elegy
pH-ja?
- Számítsa ki a 0,1 M NaHCO3 oldat pH-ját!
- Számítsa ki a [H3O+], [HSO3-]
és [SO32-] ionok koncentrációját 0,15 M-os
H2SO3 oldatban!
- Határozza meg a H2PO4-
és HPO42- ionok koncentrációit 0,2 M és
0,02 M H3PO4 oldatokban!
- Melyik vegyület oldódik kevésbé vízben, a CuS vagy HgS?
Használja a 16. táblázatot!
- Hány mol/dm3 Ag+ és I-
lesz oldatban, ha AgI port desztillált vízbe szórunk?
- Mekkora érték a PbI2 oldhatósága tiszta
vízben?
- A PbBr2 oldhatósága tiszta vízben 8,4 g/dm3 20 oC-on.
1 M NaBr oldatban oldva PbBr2-t nagyobb, vagy
kisebb lesz az oldhatóság?
- Számítsuk ki AgCl oldhatóságát
- tiszta vízben,
- 0,1 M HCl oldatban,
- 0,1 M HNO3 oldatban,
- 1 M NH4OH oldatban
ha L = 1,6·10-10 és Kc = 2,5·107 az alábbi
reakcióra:
Ag+ + 2 NH3 -> [Ag(NH3)2]+
- Számítsuk ki az ezüst-kromát (Ag2CrO4)
oldhatósági szorzatát, ha az oldhatóság, S = 1,3·10-4 M vízben.
Számítsuk ki az oldhatóságot a.) 0,01 M AgNO3 és b.) 0,01 M K2CrO4
oldatban is!
- Számítsuk ki a telített Mg(OH)2 oldat pH-ját.
Határozzuk meg "S" értékét 11 pH-jú oldatban is. Állapítsuk meg, mennyi
az a pH érték, ahol 0,01 MgCl2 oldatból Mg(OH)2 kezd lecsapódni.
- Adjuk meg az a.) CuS, b.) ZnS oldhatóságát 1 M HCl
oldatban, ha az kén-hidrogénnel telített! (A telített H2S
koncentrációja 0,1 M.)
- Adjunk óvatosan (NH4)2S oldatot 0,001 M Fe(NO3)2
és 0,001 M MnSO4 oldatokhoz. Melyik
szulfid-csapadék válik le előbb? Számítsuk ki a FeS és MnS leválásához
szükséges [S2-] ion koncentrációt. Milyen pH-tartományban válnak le a
csapadékok?
- Számítsuk ki a kén-hidrogénnel telített 1 M HCl
oldatban a HgS és a Bi2S3 oldhatóságát.
- Határozzuk meg a FeS oldhatóságát telített H2S
oldatban, ha a
- pH =7,00;
- pH =0,00!
- Mekkora az AgIO3 oldhatósága 0,01 M HIO3
oldatban?
LAgIO3= 9,2·10-9, Kc HIO3 =
1,67·10-1
- Számítsuk ki az AgIO3 oldhatóságát 2 pH-jú
oldatban!
- Számítsuk ki az PbF2 oldhatóságát 3 pH-jú
oldatban!
- Hány gramm Sb(OH)3 oldható fel 100 cm3
7,00 pH-jú puffer oldatban 18 oC-on?
- Határozza meg a telített Mn(OH)2 oldat
pH-ját!
-
- Számítsuk ki a telített Ca(OH)2 oldat
pH-ját!
- 0,01 M CaCl2 oldatba NaOH oldatot csepegtetve mekkora pH értéknél jelenik
meg az oldatban a csapadék?
-
- Számítsuk ki Fe(OH)3 és Al(OH)3
oldhatóságát 4 pH-jú oldatban.
- Adjuk meg azt a pH értéket, melynél a hidroxid-csapadékok képződnek
0,01 M FeCl3
és AlCl3 oldatokból!
- Számítsa ki a telített Fe(OH)3 és Al(OH)3
oldatok pH-ját!
- Desztillált vizet PbCl2-dal és PbI2-dal telítünk. Kiszámítható-e egyensúlyban a két anyag koncentrációja?
- Számítsuk ki a BaSO4 oldhatósági szorzatát
25 oC-on, ha ezen a hőmérsékleten 50 cm3 vízben 0,12 mg
anyag oldódik és ekkor az oldat telített!
- Mekkora a BaSO4 oldhatósága tiszta vízben,
0,1 M Na2SO4 oldatban és 0,001 M BaCl2 oldatban?
- Számítsuk ki az AgBr, illetve az AgI oldhatóságát 1
M NH4OH oldatban!
Ag+ + 2 NH3 Ű [Ag(NH3)2]+
Kc értéke a fenti egyenletre: Kc = 2,5·107
- Mekkora legyen annak az NH4OH oldatnak a
minimális koncentrációja, amely megakadályozza, hogy AgCl váljon ki 1 dm3
0,1 M AgNO3 és 0,01 M NaCl oldat összeöntésekor?
- Hány gramm CaCO3 csapadék képződik, ha 1
dm3 0,1 M CaCl2 és 1 dm3 0,1 M Na2CO3
oldatot öntünk össze?
- Hány mg Mg(OH)2 oldódik fel 1 dm3
8,5 pH-jú pufferoldatban?
- 20 oC-on 100 cm3 telített Ag3PO4 oldat 0,65
mg sót tartalmaz feloldva. Számítsuk ki az Ag3PO4
oldhatósági szorzatát!
- Az ezüst-klorid oldhatósági szorzata
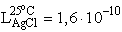 25 oC-on és
25 oC-on és 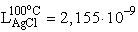 100 oC-on.
Hány mg szilárd ezüst-klorid oldódik fel 500 cm3
25 oC-on telített oldatban, ha a hőmérsékletet 100 oC-ra
emeljük?
100 oC-on.
Hány mg szilárd ezüst-klorid oldódik fel 500 cm3
25 oC-on telített oldatban, ha a hőmérsékletet 100 oC-ra
emeljük?
- Egy oldat 0,01 mol klorid- és 0,01 mol jodidiont tartalmaz. Lassan 0,1 M AgNO3
oldatot csepegtetünk az elegyhez. Azt tapasztaljuk, hogy az AgI előbb válik ki, mint az
AgCl. Az ezüst-klorid kiválásának pillanatában mekkora
lesz a még megmaradt [I-] koncentráció? Lehetséges-e a I- ion
frakcionált lecsapása Cl- mellett?
- Leválik-e a Mg(OH)2 csapadék 0,01 M MgCl2
oldatból, ha az oldathoz annyi ammóniát öntünk, hogy annak koncentrációja 0,1 M
lesz? Mekkora [NH4+] koncentráció hiúsítja meg a
kicsapódást?
- Mekkora pH értéket kell állandóan fenntartani egy
telített H2S oldatban, ha azt akarjuk, hogy 0,1 M Cd2+ és 0,1
M Zn2+ kezdeti koncentrációjú oldatokból csak a CdS váljon ki?
![]() = -840,1 kJ
= -840,1 kJ