ahol r a fajlagos ellenállás, egysége: ohm.cm,
X. Elektrokémiai számítások
Elektrolitoldatok vezetése
Valamely vezető R ellenállása egyenesen arányos a vezető hosszával (l) és fordítva arányos a vezető keresztmetszetével (q):
![]()
ahol r a fajlagos ellenállás, egysége: ohm.cm,
![]() -t pedig
-t pedig ![]() -ben vagy
-ben vagy ![]() -ben helyettesítjük
be.
-ben helyettesítjük
be.
A vezetés az ellenállás reciproka. A fajlagos vezetés
(k ) a fajlagos ellenállás reciproka:
![]()
A fajlagos vezetés számértéke az egységnyi hosszúságú (l = 1 cm) és keresztmetszetű (q = 1 cm2), vagyis 1 cm élhosszúságú, kocka alakú vezető ellenállásának reciprok értékével egyenlő. Dimenziója: S× cm-l.
Elektrolitoldatok vezetését az oldat molekulavezetésével is jellemezhetjük. A molekulavezetés (l m) az oldat fajlagos vezetéséből számítható:
![]()
ahol j az oldat hígítása (cm3 oldat/mol),
c pedig az oldat koncentrációja (mol/cm3 oldat). A molekulavezetés
dimenziója: S× cm2× mol-l.
A molekulavezetés számításánál a c koncentráció (ionkoncentráció) a moláris tömeg egységnyi oxidációfok változásra eső részének mol/dm3-ben kifejezett koncentrációját jelzi. Pl. 1 molos CuSO4 oldatban 2 mol/l 1/2 Cu2+ koncentrációt kell figyelembe venni, de a koncentrációt ezután mol/cm3-re kell átszámítani a dimenziók egyeztetése végett. Ennek megfelelően szerepelnek a relatív ionmozgékonyság (lK, ill. lA) adatok a 17. táblázatban.
Elektrolitoldatok molekulavezetése a hígítás függvényében változik a disszociációfok változása következtében. Végtelen hígítás esetén (amikor a = 1) a molekulavezetés a vegyületet alkotó ionok relatív ionmozgékonyságából (lK, ill. lA) tevődik össze. Pl. egységnyi töltésű ionokból felépített, teljesen disszociált elektrolitok esetén a végtelen hígításra extrapolált molekulavezetés (határvezetés)
![]() = lK
+ lA
= lK
+ lA
Gyenge elektrolitok disszociációfoka valamely c koncentrációnál a következő összefüggés alapján számítható:
![]()
Erős elektrolitoknál a disszociáció gyakorlatilag teljes mértékű töményebb oldatok esetén is, a relatív ionmozgékonyság érték azonban ezekben az esetekben már függ a koncentrációtól, az előbbi képlet alkalmatlan a disszocációfok számítására. Erős elektrolitok esetében általában a koncentrációk helyett aktivitásokkal kell számolnunk. (Természetesen bizonyos összefüggésekben nincs értelme az aktivitásokat használni, pl. koncentráció átszámítás.)
Elektródpotenciál, galvánelemek
A galvánelemekben kémiai átalakulás játszódik le úgy, hogy közben elektromos
munkát nyerünk. Az önként végbemenő folyamat révén az elem által végzett
maximális hasznos munka a folyamat szabadentalpia változása:
D G = -zFE,
ahol z a reakcióban résztvevő elektronok moljainak száma, F az 1 Faraday
árammennyiség (96500 coulomb), E a galvánelem elektromotoros ereje, a szabadentalpia
változás értékét joule-okban adjuk meg. (Ha a szabadentalpia változást
kalóriákban akarjuk kifejezni, akkor D G = -zˇ23062E.) Az
egyenletben a negatív előjel onnan származik, hogy előjeldefiníciónk értelmében a
rendszeren végzett munkát pozitívnak, a rendszer által végzett munkát negatívnak
tekintjük.
Valamely kémiai folyamat hasznos munkája (szabadentalpia változása) a résztvevő anyagok koncentrációinak függvénye:
DG = DG0 + RT lnQ
ahol Q a IX. fejezetben részletesen tárgyalt reakcióhányados, mely egyensúly esetén megegyezik a reakció egyensúlyi állandójával (Q=K) és DG0 a standard szabadentalpia változás, amikor a kiindulási anyagok és végtermékek aktivitása (koncentrációja) is egységnyi.
A redoxi folyamatoknak megfelelő reakció két "félreakcióra", az oxidációnak, illetve a redukciónak megfelelő elektródreakciókra bontható. Így pl. az
Sn2+ + 2Fe3+ ![]() Sn4+ + 2Fe2+
Sn4+ + 2Fe2+
reakció az alábbi két folyamatra bontható:
Sn2+ |
oxidáció |
2Fe3+ + 2e |
redukció |
A galvánelemekben a két folyamat térben is szeparálható. Mindkét folyamat jellemezhető egy D G értékkel és egy elektródpotenciállal. A galvánelem elektromotoros ereje a két elektródpotenciál különbsége. Ha a galvánelemben az elektromotoros erőt definiáló anyagok koncentrációi az egységnek felelnek meg (a szabadentalpia változás D G0), az elektromotoros erő a standard elektródpotenciálok különbségével egyezik meg:
![]()
vagyis
DG0 = -zFE0.
Fentiek alapján a kémiai folyamat szabadentalpia változásának koncentrációfüggését leíró egyenlet a következő alakban írható:
-zFE = -zFE0 + RT ln Q,
ebből
![]() .
.
Ez a Nernst-egyenlet általános alakja; 25 oC-ra vonatkoztatva és áttérve a tizes alapú logaritmusra:
![]()
Egyensúly esetén a rendszer affinitása és természetesen a galvánelem elektromotoros ereje is zéró, ami azt jelenti, hogy a két elektródpotenciál megegyezik. Az előbbi egyenlet a következőképpen alakul:
![]()
Ebből kifejezhetjük az egyensúlyi állandó logaritmusát:
log K = 16,95 zE0
Ha a galvánelem elektromotoros ereje 0 (a két elektródpotenciál megegyezik), a folyamat egyensúlyban van, kémiai reakció nem játszódik le.
Kémiai folyamatok egyensúlyi állandója kényelmesen és pontosan meghatározható a megfelelő galvánelemek elektromotoros erejének mérése alapján, ami különösen olyan folyamatoknál fontos, melyek egyensúlyi állandója más úton nem, vagy csak körülményesen határozható meg. Másrészt viszont kiszámítható az elektromotoros erő, ha az áramtermelő folyamat egyensúlyi állandója ismert, ami lehetővé teszi nem jól észlelhető elektródpotenciálok megállapítását.Ha az elektromotoros erő nem 0, a folyamat hajtóereje az elektródpotenciálok különbsége, a galvánelemben önként lejátszódó folyamat áramot termel.
Valamely elektródon lejátszódó elektródreakció általános alakja:
a ×
red ![]() b × ox + z
× e,
b × ox + z
× e,
ahol red a redoxrendszer redukált formáját, ox az oxidált formáját jelképezi, a felirásnál mindig baloldalon szerepel a redukált forma.
Az elektródreakció által definiált elektródpotenciál (e) koncentrációfüggését a Nernst-egyenlet fejezi ki:
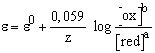
Az Sn2+ és Sn4+ ionokat tartalmazó oldat esetén a redox elektródpotenciál 25 0C-on
Ez a felirási mód akkor érvényes, ha az
Sn2+ ![]() Sn4+ + 2e
Sn4+ + 2e
elektródreakcióra vonatkozik, tehát abban az esetben, ha az elektronszám változás, z = 2.
Felírhatjuk az elektródreakciót más formában is, pl.
2 Sn2+ ![]() 2 Sn4+ + 4e
2 Sn4+ + 4e
Ekkor az átalakulás során az elektronszám változás 4, és a redoxi elektród potenciálja a következő alakban írható fel:
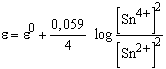
Ez a kifejezés megegyezik az előzővel, azaz a redoxpotenciál értéke független a reakcióban szereplő együtthatók felírásától.
A Nernst egyenletben tulajdonképpen az ionaktivitás (ai) szerepel, amely híg oldatok esetén az ionkoncentrációval egyenlőnek vehető, tehát azzal helyettesíthető. (A feladatokban megadott koncentráció az aktivitással azonosnak tekintendő, kivéve, ha megadjuk az aktivitási koefficiens értékét).
A fenti reakciót úgy lehet a legegyszerűbben megvalósítani, hogy Sn2+ és Sn4+ ionokat tartal-mazó oldatba indifferens (pl. Pt) elektródot merítünk, és az így kapott rendszer lesz a galvánelem egyik pólusa. Másik pólusként szóba jöhet pl. egy Fe2+/Fe3+ ionokat tartalmazó oldat, melybe ugyancsak Pt elektróda merül. A
Zn ![]() Zn2+ + 2e
Zn2+ + 2e
reakció megvalósításához elegendő egy Zn2+ ionokat tartalmazó oldat, melybe Zn rúd merül elektródaként. Az elektródpotenciált a megfelelő Nernst egyenlettel számíthatjuk ki:
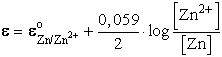
Mivel a tiszta Zn aktivitása (nem koncentrációja!) egységnyi, ezért
![]()
A Cl- ![]() 1/2 Cl2 + e reakcióhoz Cl- ionokat tartalmazó oldatba
klórelektróda merül (amely egy Pt szálból és az azt körülvevő klór-gázból
áll). A megfelelő Nernst-egyenlet:
1/2 Cl2 + e reakcióhoz Cl- ionokat tartalmazó oldatba
klórelektróda merül (amely egy Pt szálból és az azt körülvevő klór-gázból
áll). A megfelelő Nernst-egyenlet:
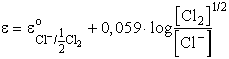
A gázok aktivitása a nyomásukkal (parciális nyomásukkal) arányos, ezért
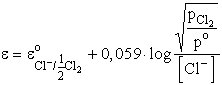
Amennyiben a gáz nyomása egyenlő 101,3 kPa nyomással, p=p0, ezért
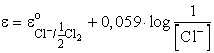
vagy másképpen írva:
![]()
e o a normál elektródponteciál, illetve 25 ° C-on a standard elektródpotenciál, amely pl. fémelektród esetén a saját ionjaira nézve egységnyi ionkoncentrációjú (ionaktivitású) oldatba merülő fémelektród és a standard hidrogénelektród közötti potenciálkülönbség árammentes állapotban mérve, azaz a két elektródból összeállított galvánelem elektromotoros ereje. A konvenció szerint 0 potenciálúnak tekintett standard hidrogénelektród (SHE) olyan gázelektród, amelynél egységnyi hidrogénion koncentrációjú oldatba merülő platinázott platina elektród felületén 101,3 kPa nyomású tiszta H2 gázt buborékoltatunk keresztül.
Galvánelemek elektromotoros erejét a két elektród potenciáljának különbsége adja meg:
E = e1 - e2
Az elektromotoros erő számításánál a pozitív elektród potenciáljából (e1) vonjuk ki a negatív elektród potenciálját (e2), mivel az E - konvenció szerint - mindig pozitív. Galvánelemek sematikus jelölésénél mindig a negatívabb elektródot írjuk a bal oldalra.
A króm +3 és +6 oxidációfokkal is szerepelhet vegyületeiben. Mindazonáltal a
Cr3+ ![]() Cr6+ + 3e
Cr6+ + 3e
reakció nem mehet végbe, mivel Cr6+ ion nem létezik, +6-os oxidációfokkal a króm csak CrO42-, vagy Cr2O72- ionok formájában található vizes oldatokban. Nyilvánvaló, hogy a reakcióban a víz, és ennek megfelelően a H+ ionok is szerepet játszanak. Az ilyen elektródok potenciálja függ a pH-tól. A reakció megfelelő együtthatóit a megszokott módon keressük meg.
|
+3 |
+6 |
|
|
Cr3+ + H2O |
|
Cr2O72- + H+ + e |
|
2 Cr3+ + 7 H2O |
|
Cr2O72- + 14 H+ + 6e |
Így a Cr3+/ Cr2O72- redoxirendszer elektródpotenciálja:
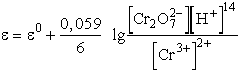
Minthogy a galvánelemek működése közben a pozitív elektródon (katódon) redukció, a negatívon (anódon) oxidáció megy végbe, abból hogy a galvánelemnek melyik pólusa pozitív, következtethetünk arra, hogy az adott körülmények között milyen irányban megy végbe az áramtermelő folyamat. A fentiekből következik az az általános szabály, hogy a galvánelem áramtermelő folyamatában a pozitív elektródnak megfelelő fém mennyisége növekszik a fémion mennyiségének rovására, ezáltal a pozitív elektród elektródpotenciálja negatívabb irányba tolódik el, a negatív elektródnak megfelelő fém mennyisége pedig fogy (az oldatba kerülő fémionok révén az ionkoncentráció nő), az elektródpotenciál így pozitív irányba tolódik el, vagyis a pozitív és negatív elektród potenciálja közeledik egymáshoz, azaz a galvánelem elektromotoros ereje csökken.
Ha tehát a galvánelemet úgy írjuk fel, hogy jobb oldalon legyen pozitív pólusa, és a reakcióegyenlet bal oldalára az elem bal oldalán levő fémet, jobb oldalára pedig az elem jobb oldalán levő fémet írjuk, akkor a folyamat az adott körülmények között balról jobbra megy önként végbe (láttuk már a 21. példa megoldása során, hogy a Daniell-elemben a Zn + Cu2+ Ű Zn2+ + Cu áramtermelő folyamat balról jobbra megy önként végbe mindaddig, amíg a Zn2+ ionok és Cu2+ ionok koncentrációjának aránya nem haladja meg 1,95× 10-37-t). Hasonló megállapítás tehető, ha az elektródok potenciálját nem egyetlen ion koncentrációja határozza meg, hanem az oxidált és redukált forma egyaránt oldott állapotban van. Értelemszerűen ebben az esetben is balról jobbra megy a reakció önként végbe, ha a reakcióegyenlet bal oldalán a pozitívabb potenciálú redoxrendszer oxidált formája és a negatívabb potenciálú rendszer redukált formája szerepel (hiszen a Daniell-elemre vonatkoztatva is az egyenlet bal oldalán felírt Cu2+ ion a pozitívabb potenciálú rendszer oxidált formája, a Zn pedig a negatívabb potenciálú rendszer redukált formája).
Noha általában az e 0 értékek (ill. a belőlük képezhető E0 értékek) szerepe döntő a folyamat lejátszódásának iránya szempontjából, a 31. példa jól szemlélteti, hogy a kémiai folyamat iránya és ezzel együtt az elem pólusainak előjele függ a komponensek (ionok) relatív koncentrációjától. Hasonló - komplexképxődéssel magyarázható jelenség tapasztalható a 35. példában.
A koncentrációs galvánelemekben az elektródok és elektrolitok anyagi minősége ugyanaz, csupán az elektrolit koncentrációjában (az ionaktivitásban) van különbség. A galvánelemekben lejátszódó folyamat hajtóereje a koncentráció különbség, a koncentrációs galvánelem elektromotoros erejét a két oldal koncentrációjának viszonya határozza meg. Az elem elektromotoros ereje 25 ° C-on (azaz standard állapotban) a következő képlettel számítható:
![]() ,
,
ahol a1 az ionaktivitás a pozitív elektród környezetében, a2 pedig az ionaktivitás a negatív elektród környezetében, minthogy az elektromotoros erő számításánál a pozitív elektród potenciáljából vonjuk ki a negatív elektród potenciálját.
Ha az elektródok a kationra nézve reverzibilisek, a töményebb oldat koncentrációja az ionoknak az elektródon történő semlegesítése révén csökken, az elektród elektronban elszegényedik, így a töményebb oldatba merülő elektród lesz a galvánelem pozitív pólusa. Ha az elektródok az anionra reverzibilisek, a töményebb oldatból az elektródon kiváló ionok elektront adnak le, így a töményebb oldatba merülő elektród a galvánelem negatív pólusa (utóbbi esetben z viszont negatív szám).
Faraday törvénye
Az elektromos töltés, ill. árammenyiség egysége a coulomb.
1 coulomb = 1 amper × sec = 2,778 × 10-4 amper óra.
Az elektromos teljesítmény egysége a watt.
watt = volt × amper
1 kWh = 1000 × 3600 joule.
Faraday törvénye értelmében valamely ion moláris tömege egységnyi oxidációfok változásra eső részének leválasztásához (általában valamely anyag moláris tömege egységényi oxidációfok változásra eső részének az elektródreakcióban való részvételéhez) 96500 coulomb, azaz 26,8 amperóra szükséges. Ezt az árammennyiséget Faraday tiszteletére F-el jelöljük. A 87. példától kezdve lehet az ilyen példákat gyakorolni.