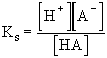
XI. Összetett egyensúlyi feladatok
Protolitikus egyensúlyok molarányai, megoszlási diagramok
Egyértékű gyenge sav disszociációs egyensúlya:
Először vizsgáljuk meg a cs koncentrációban jelenlevő gyenge savra vonatkozó egyenleteket:
HA ![]() H+ + A-
H+ + A-
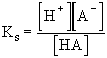
A módosulatok mennyiségére vonatkozó mérlegegyenlet: cs = [HA] + [A-].
Az [A-] koncentrációt a Ks savállandóval és [HA]-val kifejezve a disszociálatlan sav moltörtje:
A [HA] koncentrációt a Ks savállandóval és [A-]-val kifejezve a protonmentes módosulat (konjugált bázis) moltörtje:
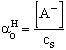 =
= 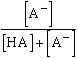 =
=
 =
=
 =
=
![]() (XI. 2)
(XI. 2)
Az a felső indexe a protolitikus egyensúlyra utal, alsó indexe pedig a forma protonszámát jelöli.
A XI. 1. ábrán látható az ecetsav módosulatainak megoszlási
diagramja a pH függvényében. Látható, ha [H+] = Ks (pH = pKs
a kifejezések számlálói is megegyeznek, akkor ![]() =
=
![]() = 0,5. Egyszerűen ellenőrízhető, hogy e pont
egyben a görbék inflexiós pontja. Az ábrán az is látszik, hogy az aértékei csak a pKs - 2 < pH < pKs + 2
tartományban térnek el jelentősen a 0, ill. 1 értékektől.
= 0,5. Egyszerűen ellenőrízhető, hogy e pont
egyben a görbék inflexiós pontja. Az ábrán az is látszik, hogy az aértékei csak a pKs - 2 < pH < pKs + 2
tartományban térnek el jelentősen a 0, ill. 1 értékektől.
Kétértékű gyenge savak disszociációs egyensúlyi viszonyai.
Jelölje cs a teljes savkoncentrációt és tekintsük a H2A kétbázisú gyenge sav disszocációját:
H2A
![]() H+ + HA-
H+ + HA-
![]()
HA-
![]() H+ + A2-
H+ + A2- 
A molszámmérleg: cs= [H2A] + [HA-]+ [A2-]
A [HA-] és [A2-] koncentrációkat a savállandók egyenleteiből [H2A]-val kifejezve kapjuk:
cs = [H2A] +
 +
+  = [H2A]
= [H2A]
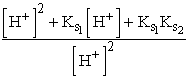
Így az egyes formák molarányai:
![]() =
=  =
=
 (XI. 4)
(XI. 4)
![]() =
= ![]() =
=
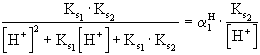 (XI. 5)
(XI. 5)
A következő oldalon néhány sav a - pH megoszlási diagramja látható. Az ábrákhoz az alábbi megjegyzéseket kell fűznünk.
Többértékű gyenge savak disszociációs egyensúlyi viszonyai.
A kétbázisú savakra nyert összefüggéseket n-bázisúakra általánosítva a következőket írhatjuk:
![]() =
= 
 =
= 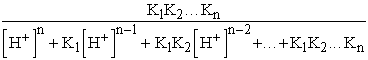
Bevezetve az a ’ = [H+]n + K1[H+]n-1 + ... + K12...Kn (XI. 6)
kifejezést az egyes módosulatok molarányai:
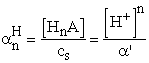 ,
,
 ,
,  (XI. 7)
(XI. 7)
ill. általában a k protont tartalmazó forma moltörtje:
 (XI. 8)
(XI. 8)
Az elhanyagolások és egyszerűsítések szerepe összetett egyensúlyokban
A IX. fejezetben láttuk, hogy egyensúlyi feladatok megoldásának sarkalatos pontja azokat az egyszerűsítéseket megtalálni, melyek nélkül a feladat sokadfokú, és rendszerint csak számítógéppel megoldható egyenletre vezet, de melyek alkalmazása ugyanakkor nem vezet pontatlan eredményre. Az alábbi eseteket tárgyaljuk.
Gyenge savak (bázisok) és erős bázissal (savval) alkotott sóinak az elegyei (pufferek).
Vizsgáljunk egy egyértékű gyenge savat, pl. ecetsavat és konjugált bázisát (sóját), pl. nátrium-acetátot tartalmazó rendszert. Legyen cs a sav, csó a só kiindulási (totális) koncentrációja. Mennyi lesz az oldat pH-ja?
A savat jelöljük HA-val, a sót A--szal.
Az oldatban a következő disszociációs egyensúlyok vannak:
HA
![]() H+ + A-
H+ + A- 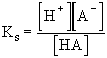
H2O
![]() H+ + OH- v=
[H+] [OH-]
H+ + OH- v=
[H+] [OH-]
Fejezzük ki a sav tömeghatástörtjéből a hidrogénion koncentrációt!
[H+] = 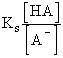
Számítsuk ki először a [HA]-t. Az oldatba vitt cs koncentrációhoz képest annyiban lesz más az egyensúlyi koncentráció [HA], hogy a sav disszociációja csökkenti, mégpedig pontosan annyival, amennyivel az [A-] növekszik csó-hoz képest. Mivel a sav disszociációja pontosan annyi A--t hoz létre, mint H+-t, ezért [A-]sav = [H+]sav. Eddig a pontig gondolatmenetünk megegyezik azzal, amit (némileg különböző formalizmussal ugyan) a IX. fejezet. 74. példa megoldása során követtünk. Minthogy azonban a fejezetben éppen az elhanyagolások szerepét igyekszünk tisztázni, nem tekinthetünk el a vízből származó H+ ionoktól. A víz autoprotolízise szerint [H+]víz = [OH-], mivel pedig a teljes hidrogénion koncentrációra felírható, hogy
[H+] = [H+]sav + [H+]víz = [H+]sav + [OH-],
ezért [HA] = cs - [A-]sav = cs -[H+]sav = cs - ([H+]-[OH-])
Tehát a sav disszociációja [H+] - [OH-] értékkel csökkentette a kiindulásihoz képest a sav koncentrációját. Természetesen szükségszerű, hogy az anion koncentrációja ugyanennyivel nőjön. A Brönsted-Charlot egyenlethez jutunk:
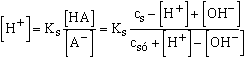
Mivel a levezetésben semmit sem hanyagoltunk el, így ennek az egyenletnek a megoldása szolgáltatja az egy disszociációs egyensúlyi állandóval leírható sav legpontosabb [H+] értékét, következőleg pH-ját.
Példák.
Gyenge savak erős bázissal alkotott savanyú sói.
Számítsuk ki egy 0,1 M NaHCO3 oldat pH-ját!
A só teljesen disszociál: NaHCO3 ®
Na+ + ![]()
A ![]() -ion, mint a szénsav első disszociációjának eredménye két folyamatban
vehet részt:
-ion, mint a szénsav első disszociációjának eredménye két folyamatban
vehet részt:
1. diszociál:
![]()
![]() H+ +
H+ +![]() ,
,
 ,
,
2. hidrolizál:
![]() + H2O
+ H2O
![]() H2CO3 + OH-
H2CO3 + OH-
 ,
,
visszaalakul szénsavvá. Kh-t a víz ionszorzatával
osztva: 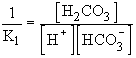
Az első folyamat protont "termel", pontosan annyit, amennyi ![]() -ion keletkezik. A
második folyamat OH--iont termel, azaz protont "fogyaszt", pontosan
annyit, amennyi H2CO3 molekula keletkezett. A vízből származó
hidrogénionok száma természetesen megegyezik a hidroxidionok számával. Eszerint a
következő egyenlet igaz.
-ion keletkezik. A
második folyamat OH--iont termel, azaz protont "fogyaszt", pontosan
annyit, amennyi H2CO3 molekula keletkezett. A vízből származó
hidrogénionok száma természetesen megegyezik a hidroxidionok számával. Eszerint a
következő egyenlet igaz.
![]()
A jobboldali kifejezésbe behelyettesítve a tömeghatástörtből a megfelelő kifejezéseket, kapjuk:

Átrendezve kapjuk:
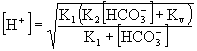
Eddigi levezetésünk semmilyen elhanyagolást nem tartalmaz. Látható
azonban, hogy a továbblépéshez legalább egy feltételezést kell tenni. Mivel K1
és K2 is kicsi, feltehető, hogy a [![]() ]= Csó, azaz az egyensúlyi só
koncentrációt és a teljes só koncentrációt azonosnak vehetjük. Ekkor
]= Csó, azaz az egyensúlyi só
koncentrációt és a teljes só koncentrációt azonosnak vehetjük. Ekkor
I. 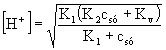
Ez töményebb oldatokban feltétlenül igaz, mint láttuk a molarány függvények menetéből. Behelyettesítve a megfelelő értékeket:
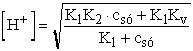 =
= 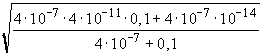 =
=
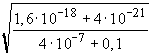 = 4,005· 10-9 ® pH
= 8,397 ® 8,40
= 4,005· 10-9 ® pH
= 8,397 ® 8,40
További jogos egyszerűsítéseket is alkalmazhatunk. Ha K2·csó >> Kv, akkor
II. 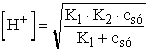 =
=
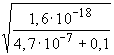 =
4,000· 10-9 ® pH
= 8,398 ® 8,40
=
4,000· 10-9 ® pH
= 8,398 ® 8,40
Ha még az is igaz, hogy csó » K1, akkor K1 + csó @ csó és
III. 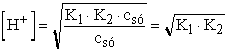 = 4,000· 10-9®
pH = 8,398 ® 8,40
= 4,000· 10-9®
pH = 8,398 ® 8,40
Ez esetben tehát jó megközelítéssel a
![]() független a só
kiindulási koncentrációjától, s az oldat savas kémhatású lesz, ha K1K2
>Kv és lúgos kémhatású, ha K1K2 <Kv.
Azt is láthatjuk, hogy egy ezred pH eltérést okoznak az elhanyagolások, ami
viszont legtöbbször nem is mérhető, így jogosult volt minden egyszerűsítésünk.
független a só
kiindulási koncentrációjától, s az oldat savas kémhatású lesz, ha K1K2
>Kv és lúgos kémhatású, ha K1K2 <Kv.
Azt is láthatjuk, hogy egy ezred pH eltérést okoznak az elhanyagolások, ami
viszont legtöbbször nem is mérhető, így jogosult volt minden egyszerűsítésünk.
Gyenge savak gyenge bázissal alkotott sói
Számítsuk ki az ammónium-formiát 0,1 M-os oldatának pH-ját! Az ammónium-formiát egy gyenge sav, a hangyasav és egy gyenge bázis, az ammónium-hidroxid sója. Ismerjük a hangyasav, ill. az ammónium-hidroxid disszociációs egyensúlyi állandóját: Ks = 2,1· 10-4, Kb = 1,8·10-5.
A só teljesen disszociál: HCOONH4 ®
HCOO- + ![]()
A kation és anion hidrolízise:
![]() + H2O
+ H2O
![]() NH4OH + H+
NH4OH + H+

HCOO- + H2O
![]() HCOOH + OH-
HCOOH + OH- 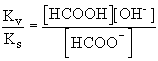
A proton vagy "szabadon" vagy hangyasavhoz kötve, hidroxidion vagy "szabadon" vagy az ammóniumhoz kötve fordulhat elő és tekintve, hogy kiinduláskor
[H+] = [OH-], ill. [HCOO-] =
![]() kell, hogy
teljesüljön.
kell, hogy
teljesüljön.
A H+-t, ill. OH--t tartalmazó formákra a molszámmérleg:
[H+] + [HCOOH] = [OH-] + [NH4OH]
a tömeghatástörtből behelyettesítve:
[H+] +

Az [OH-] =
![]() helyettesítést elvégezve és a törtet eltüntetve kapjuk:
helyettesítést elvégezve és a törtet eltüntetve kapjuk:
![]()
Ebből 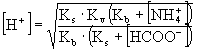
E pontig még semmiféle közelítést, vagy elhanyagolást sem használtunk.
Ha feltételezzük, hogy csó = [HCOO-] = [![]() ], akkor
], akkor
I.  =
=
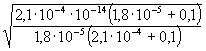
[H+] = 3,41·10-7 ® pH = 6,47,
ha csó >> Ks, ill. csó >> Kb, akkor
II. 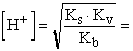
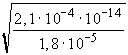 =
3,42· 10-7 ® pH
= 6,47
=
3,42· 10-7 ® pH
= 6,47
Tehát a hidrogénion koncentrációja e közelítésben független a
só kiindulási koncentrációjától. Egyszerű észrevenni, hogy ![]() egyenlő az
ammónium-hidroxid savállandójával (
egyenlő az
ammónium-hidroxid savállandójával (![]() ). Ekkor
). Ekkor
![]() , azaz a savanyú sókra levezetett összefüggést nyertük.
, azaz a savanyú sókra levezetett összefüggést nyertük.
Kétértékű gyenge sav gyenge bázissal alkotott savanyú sója
Példaként számítsuk ki egy 10-3 M NH4HCO3 oldat pH-ját! Ismerjük a szénsav mindkét savállandóját, valamint az ammónia bázisállandóját.
![]() ,
,
![]() ,
,
![]() ,
,
![]()
Az NH4HCO3 mint só teljesen disszociál: NH4HCO3® ![]()
A rendszerben a következő oldott komponensek lesznek:![]() , NH3, H2CO3,
, NH3, H2CO3,
![]() ,
,
![]() , H+, OH-,
, H+, OH-,
melyek között a következő egyensúlyok állnak fenn:
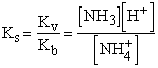 ;
;
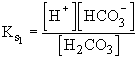 ;
;
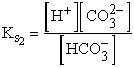 ;
;
![]()
A kiindulási ionokhoz képest az NH3, ill.
![]() és OH-
csak úgy keletkezhettek, hogy azonos számban hidrogénionok is "előálltak",
míg a H2CO3 a kiindulási HCO3--ból csak H+
felvételével (vagy OH- keletkezésével) jöhet létre. Így felírhatjuk a
protonok koncentrációjára vonatkozó mérlegegyenletet:
és OH-
csak úgy keletkezhettek, hogy azonos számban hidrogénionok is "előálltak",
míg a H2CO3 a kiindulási HCO3--ból csak H+
felvételével (vagy OH- keletkezésével) jöhet létre. Így felírhatjuk a
protonok koncentrációjára vonatkozó mérlegegyenletet:
![]()
Fejezzük ki a tömeghatástörtekből az itt szereplő mennyiségeket és helyettesítsük be egyenletünkbe!
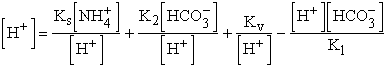
Szorozzuk be K1[H+]-szal az egyenletet:
![]()
Átrendezve: ![]()
azaz 
Élhetünk az NaHCO3 tárgyalásánál tett
egyszerűsítésekkel, ha ![]() , azaz az egyensúlyi koncentrációkat a kiindulási koncentrációkkal
vesszük azonosnak. Ez indokolt, ha a hidrolízis csak kismértékben játszódik le.
, azaz az egyensúlyi koncentrációkat a kiindulási koncentrációkkal
vesszük azonosnak. Ez indokolt, ha a hidrolízis csak kismértékben játszódik le.
I. 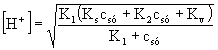 =
=
![]()
![]() ® pH = 7,81.
® pH = 7,81.
II. Ha (Ks + K2)csó >> Kv, akkor
 =
= ![]()
![]() ® pH = 7,81
® pH = 7,81
III. Ha K1 << csó, akkor a nevezőben K1 + csó= csó
![]() = 1,55·10-8, pH = 7,81
= 1,55·10-8, pH = 7,81
Látható, hogy az NaHCO3 oldat pH-jához képest az erős kationsav ammóniumion savasabbá tette a pH-t. Érdemes továbbá észrevenni, hogy az első egyszerűsítés feltételei nem teljesülnek kielégítően (csak egy nagyságrend különbség van a Kv és a (Ks + Kv·csó között és mégis a végeredményre nincs érdemi hatása, mutatva, hogy a formalizmusban a hibák kiegyenlítik egymást, és végül is jó értéket szolgáltatnak.
Komplex vegyületeken, ionokon, olyan – gyakran bonyolult összetételű – szerkezetet értünk, amelyek egyszerű ionok vagy molekulák – sokszor a klasszikus vegyértékszabályt meghaladó számban való – kapcsolódásával jönnek létre, alkotóik tulajdonságait nem mutatva. Tény, hogy egyszerű ionok csak viszonylag ritkán fordulnak elő; vizes oldatban majdnem kizárólag csak akva-komplexek léteznek. Természetes, hogy az iont körülvevő oldószermolekulák perturbálódnak az ion hatására és e perturbáció végeredménye az oldószermolekula és az ion közötti gyengébb–erősebb kölcsönhatás. Ezekután igencsak nehéz eldöntenünk, hogy egy oldószermolekula csak mint szolvatáló komponens, avagy kapcsolódó ligandum funkcionál. Szigorúan véve tehát nemigen lehet megmondani, hogy az ion körüli koordinációs szám mennyi, nyilván vannak 1, 2, ... 15 ... koordinált ionok is. Az egyes koordinációsszámok gyakoriságát azonban nem a véletlen szabja meg. Ez függ az ion és a ligandumok típusától, hőmérséklettől, nyomástól és koncentrációtól is. Adott T, p, koncentráció esetén az ion és ligandumok közötti koordinációra konszekutív egyensúlyi reakciók sorozatát lehet felírni. Így pl.
Cu2+ + NH3
![]() [Cu(NH3)]2+
[Cu(NH3)]2+
[Cu(NH3)]2+ + NH3
![]() [Cu(NH3)2]2+
[Cu(NH3)2]2+
[Cu(NH3)2]2+ + NH3
![]() [Cu(NH3)3]2+
[Cu(NH3)3]2+
[Cu(NH3)3]2+ + NH3
![]() [Cu(NH3)4]2+
[Cu(NH3)4]2+
Vizes oldatban pedig, amikor az ion akvakomplexként van jelen, a komplexképződési reakciók tulajdonképpen oldószercsere, ligandumcsere folyamatok. Így például vizes oldatban a Cu2+-ion reakciója ammóniával az alábbi egyenletekkel szimbolizálható:
[Cu(H2O)4]2+ + NH3
![]() [Cu(H2O)3NH3]2+ + H2O
[Cu(H2O)3NH3]2+ + H2O
.
.
[Cu(H2O)(NH3)3]2+ + NH3
![]() [Cu(NH3)4]2+ + H2O
[Cu(NH3)4]2+ + H2O
Ha nincs jelentősége, a koordinált vízmolekulát ezután nem jelöljük. A következőkben általában vizsgáljuk e reakciókat, a központ iont M-mel, a ligandumot L-lel jelölve (a töltéseket nem tüntetjük fel) egy komplexképződési folyamatot az alábbi sémával írhatunk le:
M + nL = MLn
Itt n a központi ion koordinációs száma. A maximális koordinációs számot n-nel jelöljük. Mi csak az ún. egymagvú komplexekkel foglalkozunk, amelyek egyetlen fémiont tartalmaznak, noha a több központi fémiont tartalmazó, ún. többmagvú komplexeknek is nagy a gyakorlati jelentőségük. (A hidroxo-komplexek jelentős része ide tartozik.) A ligandumok vonatkozásában fontos tudni, hogy az egy elektronpárral kapcsolódóakat (NH3, CN-, I-) egyfogú ligandumoknak, míg a több elektronpárral kapcsolódóakat (pl. etilén-diamin, EDTE) többfogú ligandumoknak nevezzük. A többfogúak jelentősége, hogy gyűrűs szerkezetet hoznak létre, következésképpen nagy stabilitásukkal tűnnek ki.
Ha n>1, akkor a komplexképződés lépcsőzetesen történik az alábbi séma szerint:
M + L
![]() ML
ML
![]()
ML + L
![]() ML2
ML2
![]()
MLn-1 + L
![]() MLn
MLn

ahol mindjárt felírtuk a reakciók mellé a tömeghatás törteket; K1, K2, ..., Kn pedig az ún. lépcsőzetes stabilitási (képződési) állandók. Ezek szorzatai a kumulált (globális) stabilitási állandók vagy komplex szorzatok (b ).
Az első egyenletből kifejezzük az első komplex koncentrációját és a másodikba helyettesítjük, a kapott egyenletből ezután kifejezzük a második forma koncentrációját és a harmadikba helyettesítjük, s azt tovább folytatva a következő egyenletekhez jutunk:
[ML] = K1[M][L] = b 1[M][L] (XI. 9)
[ML2] = K12[M][L]2 =b 2[M][L]2 (XI. 10)
.
.
[MLn] = K1K2..Kn[M][L]n<= b n[M][L]n (XI. 11)
azaz
b1 = K1, b2 = K1K2, bn = K1K2...>Kn
A stabilitási állandók legtöbbször monoton csökkenő sorozatot alkotnak, azaz: K1 > K2 > K3
de vannak példák az említett szabálytól való eltérésre (pl.: ezüst-amin, cink-amin komplexek), továbbá előfordul, hogy nem minden fokozat stabilitási állandója ismert (mert pl. nem tudták meghatározni).
A fémion összes mennyiségére vonatkozó mérleg:
cM = [M] + [ML] + ... [MLn]
Az egyensúlyi állandók (9)-(11) felhasználásával pedig:
cM = [M] + b 1[M][L] + ... b n[M][L]n (XI. 12)
ahol b0 = 1. A ligandum összes mennyisége a következő egyenlettel fejezhető ki:
cL = [L] + [ML] + 2 [ML2] + n[MLn]
ill. a komplexszorzatok segítségével:
cL = [L] + b 1[M][L]
+ 2b 2[M][L]2 +... + nb
n[M][L]n, másképp: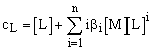 (XI. 14)
(XI. 14)
Az oldatban a különböző koordinációjú komplex formák aránya:
ahol a alsó indexe az illető komplex koordinációs száma.
A (XI. 9)-(XI. 11) egyenletek segítségével az i-edik komplex molaránya:
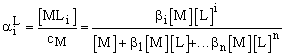
rövidebben
![]() (XI.17)
(XI.17)
ahol a = 1 + b1 [L] + b2 [L]2 +... +b n [L]n (XI.18)
egy, csak a globális állandóktól és a ligandum koncentrációtól függő polinom.
Fontos észrevenni, hogy az egyes ai értékek csak a szabad (egyensúlyi) ligandumkoncentrációtól függenek!
Az összefüggések hasonlatosak a protolitikus egyensúlyoknál megismertekkel, de míg azoknál disszociációs állandókkal dolgoztunk, addig itt a képződési állandókkal írtuk fel az egyenleteket. Az első disszociációs egyensúlyi állandó az n-edik képződési állandó reciprokával, a második disszociációs állandó az n-1-edik képződési állandó reciprokával egyenlő. Tehát matematikailag semmi különbség nincs a savak tárgyalásánál használt disszociációs és a komplexeknél elterjedten használt asszociációs (képződési) formalizmus között. (Sok modern felfogású könyv a sav-bázis egyensúlyokat is képződési egyensúlyként vizsgálja, kihasználva ezzel az egyöntetű tárgyalásmód nyújtotta előnyöket.)
Könnyen ellenőrizhető, hogy a korábban megismert – disszociációs állandókkal felírt – a' polinom és a most definiált – képződési állandókkal kifejezett – aközött a következő összefüggés van (lásd a XI.6 kifejezést, ahol [L] helyett [H]+ szerepel):
A továbbiakban legtöbbször előforduló kifejezést részletesen kiírva mindkét formalizmussal:
A következő oldalon néhány komplex (XI.
15) összefüggések alapján számított megoszlási diagramjai találhatók. Ezek a
protolitikus egyensúlyoknál látottakhoz igen hasonló képet mutatnak, csak itt
gyakrabban fordul elő a "görbék egymásra csúszása", jelezve, hogy a
komplexképződési állandók sokszor igen közeli értékek. Az ott tett megjegyzések
itt csak részben érvényesek, mivel a komplexképződési állandók nem alkotnak
szigorúan monoton sorozatot. A görbék metszéspontjai természetesen most az
![]() ligandum-koncentrációnál vannak, ill. a nem szomszédos molarány egyenlőségek
ligandum-koncentrációja szintén "reciprokos":
ligandum-koncentrációnál vannak, ill. a nem szomszédos molarány egyenlőségek
ligandum-koncentrációja szintén "reciprokos":
![]() .
.
Az itt levezetett összefüggésekkel kiszámíthatjuk az egyes formák moltörtjeit, ill. molkoncentrációját. Két csoportra oszthatjuk a feladattípusokat aszerint, hogy ismerjük a szabad ligandum (egyensúlyi) koncentrációt vagy sem.
Ha ismerjük az egyensúlyi ligandumkoncentráció értéket [L]-t,
akkor (XI.19) segítségével kiszámítjuk a polinom értékét, ill. (XI.17)
felhasználásával a megfelelő
![]() moltörteket, majd végezetül, ha cM ismeretes, akkor (XI.16) összefüggésekkel a molkoncentrációkat, vagy ha
[M] ismert, akkor előbb (XI.14)-ből cM-et
számítjuk ki és ugyanúgy járunk el, mint előbb.
moltörteket, majd végezetül, ha cM ismeretes, akkor (XI.16) összefüggésekkel a molkoncentrációkat, vagy ha
[M] ismert, akkor előbb (XI.14)-ből cM-et
számítjuk ki és ugyanúgy járunk el, mint előbb.
Ha [L] nem ismeretes, akkor (XI.13) és (XI.15) egyenletek megoldásával lehet [L]-t kiszámolni és visszavezetni a probléma megoldását az előbbi esetre. Ez azonban sokszor gondot okoz, mert az 1:1 összetételű komplexeket kivéve a probléma megoldása másodfokúnál magasabb fokú egyenletek megoldását igényli, ezért a továbbiakban az esettel nem foglalkozunk. Két fontos esetben azonban lehetőségünk van [L] megfelelő becslésére:
ha cL nagy, azaz a ligandum jelentős feleslegben van jelen. Ilyenkor feltételezhetjük, hogy a fémionok a maximális koordinációsszámú formában vannak jelen, az egyensúlyi ligandumkoncentráció pedig egyenlőnek vehető a ligandumfelesleggel. Tehát [MLn] ~ cMés [L] = cL - n [MLn].
ha valamelyik komplex igen stabilis, pl. az ML2 összetételű, akkor sokszor jó közelítés csak ennek egyensúlyi kifejezésével számolva megkeresni [L]-t. (Példánkban tehát 2 [M] = [L] és [ML2] » c-[M] összefüggések felhasználásával a b2-re vonatkozó tömeghatástörtből közelíteni az egyensúlyi ligandum koncentrációit.)
Fontos azonban, hogy utólag a feltételezések jogosságát az eredmények alapján ellenőrizzük.